
目录
胆道癌 1.1 生成胆道癌细胞系图谱,确定分子亚型和治疗靶点 1.2 1.3 基因组特征和肿瘤免疫微环境的改变可预测晚期胆道癌患者的免疫疗法效果 1.4 接受度伐利尤单抗治疗的晚期胆道癌患者达到维持治疗目标的相关因素: 一项多中心、跨国研究的真实世界结果 1.5 对度伐利尤单抗上市后安全性的药物警戒分析 |
2.1 系统性递送钙粘蛋白17特异性CAR-T细胞可有效且安全地靶向结直肠癌肝转移 |
Generation of a biliary tract cancer cell line atlas identifies molecular subtypes and therapeutic targets
生成胆道癌细胞系图谱,确定分子亚型和治疗靶点
Vijay V, et al. Cancer Discov. 2025 May 12.
中科院分区:1区 医学
IF:33.3
原文网址:https://aacrjournals.org/cancerdiscovery/article/doi/10.1158/2159-8290.CD-24-1383/762307/Generation-of-a-biliary-tract-cancer-cell-line
胆道癌是一类侵袭性强的恶性肿瘤,涵盖肝内和肝外
Durvalumab plus chemotherapy in advanced biliary tract cancer: 3-year overall survival update from the phase III TOPAZ-1 study
度伐利尤单抗联合化疗治疗晚期胆道癌: III期TOPAZ-1研究的3年总生存期的更新
中科院分区:1区 医学
IF:33.0
原文网址:https://www.sciencedirect.com/science/article/pii/S0168827825022019?via%3Dihub
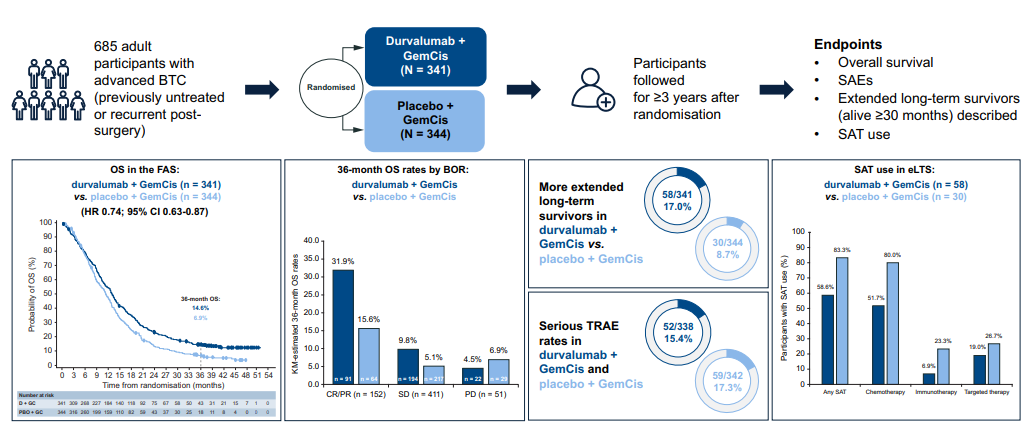
背景&目标:在TOPAZ-1 (NCT03875235)的主要分析中,度伐利尤单抗联合
方法:晚期胆道癌患者每3周接受一次度伐利尤单抗联合吉西他滨和顺铂或安慰剂联合吉西他滨和顺铂治疗(≤8个周期),然后每4周接受一次度伐利尤单抗或安慰剂单药治疗,直至达到疾病进展或其他停药标准。分别在完整分析集和安全性分析集中评估OS和严重不良事件。对eLTS结果进行评估(完整分析集中随机分组后存活≥30个月的参与者)。
结果: 纳入685例参与者接受随机治疗:度伐利尤单抗联合吉西他滨和顺铂(n=341);安慰剂联合吉西他滨和顺铂(n=344)。在对所有参与者进行中位41.3个月(95% CI 39.3-44.1)的随访后,度伐利尤单抗联合吉西他滨和顺铂对比安慰剂联合吉西他滨和顺铂的中位总生存期(95% CI)分别为12.9个月(11.6-14.1)与11.3个月(10.1-12.5)(风险比为0.74 [95% CI 0.63-0.87]);36个月总生存期率分别为14.6%与6.9%。在达到疾病控制的参与者中(566/685;82.6%),度伐利尤单抗联合吉西他滨和顺铂(17.0%)的36个月总生存期率高于安慰剂联合吉西他滨和顺铂(7.6%)。总体而言,12.8%的患者为eLTS,其中度伐利尤单抗联合吉西他滨和顺铂(17.0%)与安慰剂联合吉西他滨和顺铂(8.7%)治疗组的eLTS较多;eLTS包括所有临床相关亚组。无论随后是否使用抗癌疗法,度伐利尤单抗联合吉西他滨和顺铂都能改善总生存期。在eLTS中,两组严重不良事件发生率相当,低于完整的安全性分析集。
总结:与安慰剂联合吉西他滨和顺铂相比,度伐利尤单抗联合吉西他滨和顺铂在最后一名参加随机受试的患者约3年后仍具有生存获益和可控的安全性。所有临床相关亚组在 eLTS 中均有代表,支持度伐利尤单抗联合吉西他滨和顺铂在晚期胆道癌中的标准治疗地位。
影响:度伐利尤单抗联合吉西他滨和顺铂被批准用于晚期胆道癌的治疗,基于随机,双盲,III期TOPAZ-1研究的主要分析表明,与安慰剂联合吉西他滨和顺铂相比,度伐利尤单抗能显著提高总生存期。本次更新分析了总生存期和安全性、长期生存者数据以及后续抗癌疗法的使用情况,中位随访时间为 41.3 个月,据我们所知,这是迄今为止对晚期胆道癌患者进行的最长随访研究。度伐利尤单抗联合吉西他滨和顺铂持续带来生存获益和可控的安全性,所有临床相关亚群都在长期生存者中有所体现,而且无论后续是否使用抗癌疗法,度伐利尤单抗联合吉西他滨和顺铂都能带来总生存期获益。这些长期随访结果支持了在晚期胆道癌中使用度伐利尤单抗联合吉西他滨和顺铂的标准治疗地位,并使医生、患者和护理人员能够做出明智的治疗决定。
Alterations in genomic features and the tumour immune microenvironment predict immunotherapy outcomes in advanced biliary tract cancer patients
基因组特征和肿瘤免疫微环境的改变可预测晚期胆道癌患者的免疫疗法效果
Huang C, et al. Br J Cancer. 2025 Jun;132(11):1072-1082.
中科院分区:2区 医学
IF:6.8
原文网址:https://www.nature.com/articles/s41416-025-03011-7
背景:晚期胆道癌对免疫疗法的应答有限,在临床上,预测治疗应答是一项严峻的挑战。
方法:本研究共包含60例接受抗PD-1治疗的晚期胆道癌患者。在这其中,30例患者接受了520基因面板测序,50例患者接受了多重循环细胞因子检测。熵值及突变特征通过基于既往研究优化的分析流程进行分析。使用重复LASSO算法筛选最优特征。通过分析胆道癌单细胞转录组数据(GSE125449),探究序列特征与细胞通讯之间的关联。使用Cox回归分析建立综合模型。使用时间依赖性C指数、Kaplan–Meier生存曲线以及受试者工作特征曲线评估模型的预测性能。
结果:TP53,NRAS,FBXW7和APC被识别为与预后相关的基因。在总生存期预测中,序列熵(0.819)和突变特征(0.817)的平均C指数显著高于肿瘤突变负荷(TMB,0.392)和突变评分(0.638)。单细胞转录组数据显示,TP53、KRAS和NRAS在
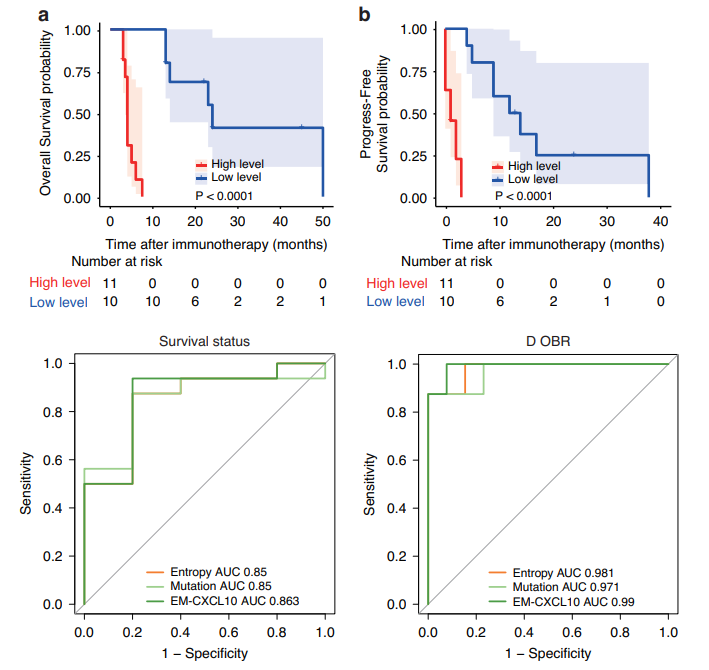
总结:本研究构建了一种多维策略,可以显示胆道癌免疫疗法的预后,从而识别出能从免疫疗法中获益的胆道癌患者,为个性化临床决策提供指导。
Factors associated with reaching maintenance therapy in patients with advanced biliary tract cancer treated with durvalumab: Real-world results from a multicenter and multinational study
接受度伐利尤单抗治疗的晚期胆道癌患者达到维持治疗目标的相关因素: 一项多中心、跨国研究的真实世界结果
Rimini M, et al. Int J Cancer. 2025 May 19.
中科院分区:2区 医学
IF:4.7
原文网址:https://onlinelibrary.wiley.com/doi/10.1002/ijc.35481
晚期胆道癌的标准一线治疗方案包括吉西他滨、顺铂、度伐利尤单抗的化学免疫治疗,随后以度伐利尤单抗单药维持治疗。本文旨在探讨在化学免疫治疗期间出现早期进展的患者,与接受度伐利尤单抗单药维持治疗阶段的患者之间的基线临床和分子特征是否存在差异。研究人群包括从2021年7月份开始到2023年12月份期间,在12个国家的38家临床机构接受治疗的不可切除、局部晚期或转移性胆道癌患者。研究的主要终点为比较在化学免疫治疗期间出现疾病进展的患者与接受度伐利尤单抗单药维持治疗的患者在基线临床和分子特征上的差异。本研究共纳入448例患者。其中227例患者(50.7%)接受了度伐利尤单抗单药维持治疗,而221例患者(49.3%)因在完成8个周期前即在一线化学免疫治疗期间出现疾病进展而未能进入维持治疗阶段。研究结果显示,接受维持治疗的患者更可能为高龄(≥70岁)、ECOG评分为0、局部晚期,且中性粒细胞与淋巴细胞比值(NLR)<3。同时,携带BAP1突变的患者更可能进入维持治疗阶段,而TP53突变则更常见于早期进展的患者。根据现有的分析,在接受化疗联合度伐利尤单抗单药维持治疗的晚期胆道癌患者中,有相当比例(50.7%)进入了度伐利尤单抗单药维持治疗阶段,中位治疗周期为4.4个周期。年龄≥70岁、ECOG评分为0、局部晚期疾病以及NLR<3的患者更有可能进入维持治疗阶段。
A pharmacovigilance analysis of post-marketing safety of durvalumab
对度伐利尤单抗上市后安全性的药物警戒分析
Tan AJ, et al. Sci Rep. 2025 May 13;15(1):16661.
中科院分区:3区 综合性期刊
IF:3.9
原文网址:https://www.nature.com/articles/s41598-025-01583-1
度伐利尤单抗在多种恶性肿瘤中已展现出显著疗效,然而关于其大规模真实世界安全性的研究仍然有限。本研究旨在通过美国食品药品监督管理局不良事件报告系统(FAERS)数据,系统评估度伐利尤单抗的安全性。提取了2017年1月到2024年6月期间FAERS数据库中将度伐利尤单抗列为主要疑似药物的不良事件报告。采用四种失衡分析法检测度伐利尤单抗与不良事件之间的信号关联。度伐利尤单抗在10120份报告中被列为主要疑似药物。在这其中,43.6%的不良事件发生在治疗首月内,中位发生时间为40天(四分位距:14–99天)。在检测出的181个潜在信号中,有64项为处方说明书中未列出的首选术语,包括细胞因子释放综合征,肺结核,放射性食管炎,食管瘘,食管穿孔,胸腔积液,气胸,脑梗死,胆道感染,胆囊炎,银屑病样皮炎,门静脉血栓,急性胆管炎及恶性心包炎等。严重不良事件占全部病例的93.3%。男性发生严重结局的风险显著高于女性(OR = 1.83,95% CI:1.52–2.19,P < 0.001);老年人群的严重结局风险亦显著高于65岁以下人群(65–74岁:OR = 1.52,95% CI:1.15–2.00,P = 0.003;≥75岁:OR = 1.40,95% CI:1.02–1.92,P = 0.038)。本研究全面评估了度伐利尤单抗的安全性,发现了若干潜在新的不良事件信号,或许能够为度伐利尤单抗的风险识别与监测提供关键支持。
Systemic delivery of cadherin 17-specific CAR T cells allows effective and safe targeting of colorectal cancer liver metastases
系统性递送钙粘蛋白17特异性CAR-T细胞可有效且安全地靶向结直肠癌肝转移
Greco B, et al. Sci Transl Med. 2025 May 28;17(800):eadr1928.
中科院分区:1区 医学
IF:14.6
原文网址:https://www.science.org/doi/10.1126/scitranslmed.adr1928?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
肝转移是结直肠癌(CRC)患者死亡的主要原因。在这种情况下,嵌合抗原受体(CAR)T细胞疗法前景可期,但要将其应用于临床,需要在临床相关模型中进行严格的抗原筛选与测试。我们确定钙粘蛋白-17(CDH17)为结直肠癌肝转移CAR T细胞疗法的候选抗原。因此,设计了在抗原结合和细胞外间隔区存在差异的人CDH17 CAR,并在临床前模型中比较了不同构建体的抗肿瘤疗效、细胞因子释放综合征和靶向非肿瘤毒性。不同结合域在体外的疗效不同,而间隔区则影响了CAR T细胞在体内的动力学表现。在结直肠癌肝异种移植模型中,全身或局部给药时,CDH17 CAR T细胞均可有效抑制肿瘤生长。然而,在重建了人类免疫系统的小鼠中进行测试时,局部注射的CAR T细胞会引发特别严重的细胞因子释放综合征。共聚焦显微镜检查显示,CDH17在肿瘤细胞的整个表面表达,而其在健康结肠中的表达仅限于上皮细胞之间的侧向连接。因此,CDH17 CAR T细胞对CRC组织切片的反应表现出剂量依赖性的细胞因子释放,而对健康结肠组织样本无反应。总体而言,这些发现支持将CDH17 CAR T细胞全身给药作为一种安全有效的治疗结直肠癌肝转移的方法,并为I/II期临床试验铺平了道路。
声明:本材料由阿斯利康提供,仅供医疗卫生专业人士参考,不可用于推广目的。
审批号:CN-170030
有效期:2026-10-27
审核:Aurora
排版:Aurora
执行:Aurora

(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)