来源:中华胰腺病杂志
1型自身免疫性胰腺炎的药物治疗
刘宗豪 周春华 邹多武
上海交通大学医学院附属瑞金医院消化内科,上海 200025
通信作者:邹多武
上海交通大学医学院附属瑞金医院消化科、消化内镜中心主任
邹多武,主任医师、教授、博士生导师,上海交通大学医学院附属瑞金医院消化科、消化内镜中心主任。目前担任中华医学会消化病学分会副主任委员、中华医学会消化病学分会功能性胃肠病协作组组长、中华医学会消化内镜学分会大数据协作组副组长、中国医师协会消化医师分会常委、中国医师协会内镜医师分会常委、上海市医学会消化病学分会主任委员、《中华消化杂志》副总编辑等学术职务。曾获国家科技进步奖二等奖、国家级教学成果奖二等奖、全军教学成果奖三等奖、军队医疗成果奖(二等奖、三等奖)、上海市临床医疗成果奖二等奖、上海市科技进步奖一等奖各1项。已发表论文130余篇(其中SCI收录84篇,总计影响因子366.043,其中以第一和通讯作者发表Gastroenterology、Journal of clinical investigation等SCI收录论文65篇。共同主编《消化系功能性和动力障碍性疾病》、《胃肠道疾病内镜诊断与治疗学》。积极开展临床和基础研究,聚焦肠道纤维化、胰腺疾病及消化内镜技术创新、功能性胃肠病及胃肠动力障碍性疾病。主持国家自然科学基金重点专项1项、国家自然科学基金面上项目7项、国家科技部“十四五”重点研发计划子课题1项、国家自然科学基金国际合作项目1项、上海市科委项目3项等多项课题。先后被评为上海市“青年科技启明星”、上海市“医苑新星”,获国之名医“优秀风范”奖。
1型自身免疫性胰腺炎是一种以胰腺慢性炎症和纤维化为主要特征的慢性炎症性疾病,经典治疗手段如糖皮质激素、单克隆抗体及免疫调节剂在自身免疫性胰腺炎诱导治疗和维持治疗中起到关键作用,但常伴随显著的药物不良反应。近年来,生物制剂和小分子靶向药物因具有更高的靶向性和潜在疗效,逐渐成为1型自身免疫性胰腺炎治疗的新方向。本文系统梳理1型自身免疫性胰腺炎的主要药物治疗进展,旨在为该疾病临床管理和新疗法开发提供参考与启示。
自身免疫性胰腺炎(autoimmune pancreatitis, AIP)是一种以胰腺慢性炎症和纤维化为主要特征的慢性炎症性疾病,患病率约为10.1/10万。根据其病理特征,AIP可分为两型,其中1型AIP又称淋巴浆细胞硬化性胰腺炎(lymphoplasmacytic sclerotic pancreatitis, LPSP),病理学特征为大量淋巴细胞及浆细胞尤其是IgG4阳性浆细胞浸润,因此又被归类为IgG4相关性疾病(IgG4related disease, IgG4⁃RD)。IgG4⁃RD是一种系统性疾病,可累及几乎所有器官和组织,包括胰腺、胆道、唾液腺、泪腺、腹膜后、肾脏、肺脏、主动脉等。2型AIP又称特发性导管中心性胰腺炎(idiopathic duct centric pancreatitis, IDCP),其病变相对局限。我国人群AIP主要以1型为主,可能达90%以上。口服糖皮质激素(glucocorticoid, GC)目前已成为1型AIP的一线治疗方案。多种免疫调节剂以及单克隆抗体也显示出一定疗效。此外,随着生物制剂和小分子靶向药物的不断发展,这些新型药物显示出靶向性强、潜在疗效显著等优势。笔者基于团队近年来在AIP领域的临床诊疗及研究基础,系统梳理和总结1型AIP药物治疗指征、治疗策略和具体方案,旨在为该疾病的规范化药物治疗和后续研究提供参考。
一、药物治疗指征
尽管绝大多数(97%~100%)1型AIP对类固醇治疗具有反应性,但也有部分(可能高达55%)患者存在自愈倾向。因此,是否所有患者均需要接受药物治疗仍存在一定争议。国际胰腺病学协会(International Association of Pancreatology, IAP)指出,对于所有未经治疗的活动性1型AIP患者,GC应作为一线治疗方案。欧洲联合胃肠病学会(United European Gastroenterology, UEG)则指出,凡是存在临床症状(如疼痛、阻塞性黄疸等)的患者,均应接受GC作为初始全身治疗。在部分情况下,也可放宽药物治疗的指征。
需要指出的是,手术治疗通常不适用于1型AIP。仅在完成系统诊断性检查(包括穿刺活检)后仍无法排除胰腺癌可能性时,方可考虑手术干预。一项研究显示,6.7%的1型AIP患者同时伴有胰腺肿瘤,两者在影像学上难以区分。另一项对288例胰十二指肠切除术患者的回顾性研究发现,8.4%为良性病变,而AIP在其中的比例高达30.4%。这些结果提示,合并胰腺肿瘤的1型AIP的确术前诊断困难,在难以明确诊断时,需要手术干预。
二、药物治疗策略
1型AIP的药物治疗需要遵循一定的策略,具体分为诱导治疗、维持治疗和长期治疗管理。
诱导治疗方面,GC仍是最有效的治疗手段。对于存在GC禁忌证、耐药或对药物不耐受的患者,UEG指南建议可联合免疫调节剂进行诱导治疗;若仍无效,则可考虑使用利妥昔单抗(rituximab, RTX)。相比之下,IAP指南则更倾向于优先选择RTX而非免疫调节剂。一项荟萃分析比较了3种方案在AIP诱导阶段的疗效,结果显示,GC联合免疫调节剂的缓解率最高,其次为GC单药和RTX单药诱导。此外,静脉GC脉冲疗法在部分难治性1型AIP尤其伴胆道病变患者中亦显示出一定疗效。对于复发患者,日本AIP指南建议可再次给予标准GC治疗,或采用更高剂量的GC诱导治疗。同时,考虑到GC治疗的长期不良作用,UEG指南推荐进一步使用免疫调节剂或RTX进行干预。目前,RTX在复发性1型AIP中的疗效已被多项研究证实,其不仅能有效诱导缓解,还具有较好的安全性和耐受性。
1型AIP的复发率较高,通常需要进行维持治疗。对于疾病活动度较低的患者,可考虑在3个月内逐步减量并停用GC维持;而对于具有复发高危特征的患者,如血清IgG4显著升高、治疗后IgG4持续升高、胰腺弥漫性肿大、胆管近端受累和多器官受累,可能更适合延长GC维持治疗疗程,或加用免疫调节剂或RTX进行维持。药物选择在地区使用上存在差异,部分亚洲国家更倾向于延长GC维持,而欧洲国家则更偏好加用免疫调节剂或RTX。与单用GC相比,GC联合免疫调节剂往往能带来更低的复发率。不过,不同免疫调节剂之间可能存在疗效不一。例如,GC联合沙利度胺的维持治疗取得良好效果,但联合甲氨蝶呤则未能成功;Peng等发现无论是否停用低剂量GC,使用免疫调节剂均能显著降低1型AIP的复发风险;而Sodikoff等则强调吗替麦考酚酯需与GC联合使用方能发挥作用。Luo等发现GC联合吗替麦考酚酯的效果不及环磷酰胺;但与来氟米特相比,GC联合吗替麦考酚酯则表现出更佳的维持疗效。可见,关于不同免疫调节剂在1型AIP疗效中孰优孰劣,还需要更多对比研究。相较于免疫调节剂,RTX在维持治疗中表现出更优的缓解效果。一项荟萃分析亦提示,RTX在降低复发方面甚至可能优于GC联合免疫调节剂。总的来说,GC、免疫调节剂以及RTX在降低AIP复发方面均显示出一定优势,但仍需要更多高质量的研究加以验证。
在长期治疗管理方面,需要关注胰腺的内分泌和外分泌功能变化。1型AIP部分患者常合并胰腺内外分泌功能不全。针对这些患者,国内AIP诊治指南推荐应用胰酶替代治疗。常用方案为外源性胰酶制剂,尤其是富含高活性脂肪酶并具有包衣结构的制剂,可有效改善患者消化吸收功能。在胰腺内分泌功能方面,1型AIP合并的糖尿病主要源于胰岛素分泌不足,而非胰岛素抵抗。近期研究发现,GC对近一半诊断时合并糖尿病的AIP患者糖尿病病程起有益的作用,尤其对诊断时血清谷氨酰转移酶水平未升高且激素治疗后未出现胰腺萎缩的患者。低剂量胰岛素维持治疗亦可能是一种有效的辅助治疗策略,但仍缺乏充分的临床证据支持。此外,一项AIP随访研究发现,AIP患者多种微量元素、营养素缺乏症的发生率较高(38%),其中以维生素D和锌缺乏最为常见。因此,监测可能出现缺乏的微量元素、营养素水平,及时纠正微量元素、营养素失衡在1型AIP的疾病管理和长期转归中均值得重视。
三、药物治疗方案
1. 糖皮质激素:GC能够有效抑制一系列免疫反应以及炎症反应,对1型AIP具有确切疗效,被认为是1型AIP诱导治疗和维持治疗的一线药物。诱导治疗的GC初始剂量为每日0.6~0.8 mg/kg,即30~40 mg/d,持续2周后评估疗效;若GC确切有效,可逐渐减量(5 mg/周),直至维持剂量2.5~5 mg/d,并持续2~3个月。另一种可接受的减量方案是40 mg/d维持4周后逐渐减量(5 mg/周),直至停药。然而,目前最佳诱导治疗和维持治疗的GC剂量以及持续时长仍未确定,尚需更多研究。此外,在开始GC治疗前,需要排除激素使用的禁忌证(如结核感染);如果存在乙肝病毒携带,需要预防性应用抗病毒药物;同时,应积极评估并处理可能存在的合并症(如重度梗阻性黄疸和糖尿病)。评估治疗反应的指标主要包括临床症状改善、生物化学指标(如肝酶、血清IgG与IgG4水平)及影像学变化;若2周后疗效欠佳,应重新评估1型AIP的诊断。除标准方案外,静脉GC脉冲治疗是另一种常见的治疗策略。常见方案为甲泼尼龙500 mg/d,连续3 d,共2个疗程。GC脉冲可作为有效的诱导治疗替代方案,尤其适用于部分对口服GC反应欠佳的良性胆管病变患者。需要注意的是,大剂量和长期服用GC往往会带来一系列不良反应,包括代谢紊乱、骨质疏松、感染风险增加以及心血管并发症等,影响患者的生活质量及长期依从性。因此,在治疗过程中需密切关注不良反应并预防。
2. 免疫调节剂:免疫调节剂通过多途径抑制机体免疫反应,在1型AIP的治疗中发挥一定作用。这些药物通常单药缓解效果有限,多需与GC联合使用。目前,已有多种免疫调节剂进入临床试验阶段探索其在1型AIP中的应用价值(表1)。硫唑嘌呤是目前应用最广泛的免疫调节剂之一,在反复复发或对GC耐药的1型AIP患者中,可作为维持治疗的替代方案。吗替麦考酚酯的使用更倾向于与GC联合,用于维持治疗。笔者团队正在开展相关临床研究(注册号:NCT06468709),以评估吗替麦考酚酯联合GC在复发高危型1型AIP患者维持治疗中的作用,初步发现吗替麦考酚酯联合GC能够有效降低该类患者的复发率。近年来,甲氨蝶呤在1型AIP中应用的研究逐渐增多,尤其在诱导缓解方面显示出潜力。Della⁃Torre等报道了在GC治疗IgG4⁃RD约5周后加用甲氨蝶呤,部分患者在GC减量甚至停药的情况下,仍能维持临床症状和影像学缓解。来氟米特与GC联合使用能够有效预防IgG4⁃RD的复发。环磷酰胺在1型AIP中应用的临床证据不多。国内一项前瞻性队列研究表明,环磷酰胺联合GC较单用GC可显著提高IgG4⁃RD的缓解率,并降低1年内复发风险。钙调神经磷酸酶抑制剂(如环孢素A、他克莫司)在其他免疫相关疾病中应用广泛,但目前在1型AIP中应用的临床证据十分有限。此外,免疫调节剂在1型AIP中的长期应用需要定期监测血常规及肝肾功能指标,以确保治疗安全性。
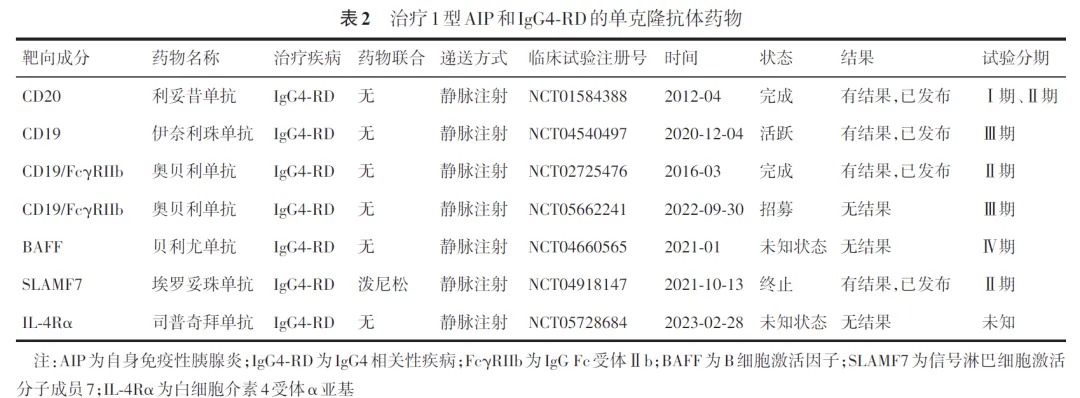
3. 单克隆抗体:在GC禁忌、耐药或不耐受,以及对免疫抑制剂治疗无反应或疾病反复复发的AIP患者中,RTX已成为一种有效的二线替代治疗选择,并可作为单药诱导缓解。但由于RTX起效较为缓慢,对于伴有黄疸的患者,仍需在早期优先考虑使用GC治疗。RTX通过特异性识别并结合血液中的B细胞,继而通过多种机制介导全身B细胞清除,从而抑制包括胰腺在内的病理性免疫反应及纤维化进展,改善患者的临床表现,因此被称为“B细胞耗竭疗法”。多项荟萃分析已证实其在1型AIP诱导治疗和维持治疗中的有效性。RTX常用给药方案包括375 mg/m2每周1次,连用4周后每2~3个月维持1次,或每6个月内进行2次输注,每次1 000 mg,间隔15 d。同时,其维持治疗可达2年。除RTX外,其他多种靶向B细胞的单克隆抗体正在临床试验阶段。伊奈利珠单抗与奥贝利单抗均为抗CD19单克隆抗体,与抗CD20单抗比较,它们能够更直接地靶向浆细胞和浆母细胞,从而覆盖更广泛的B细胞谱系。最近新英格兰医学杂志一项前瞻性研究显示,伊奈利珠单抗可显著降低IgG4⁃RD的复发风险,并提高患者在1年时维持无复发完全缓解的比例,尤其在胆道和胰腺受累的IgG4⁃RD患者中疗效更为显著。此外,一些非B细胞靶向的单克隆抗体亦在积极探索中,如靶向信号淋巴细胞激活分子成员7(signaling lymphocytic activation molecule receptor family7, SLAMF7)的埃罗妥珠单抗以及靶向白细胞介素4受体α亚基(interleukin⁃4 receptor alpha chain, IL⁃4Rα)的司普奇拜单抗(表2)。
4. 小分子靶向药物:尽管目前新型小分子靶向药物在1型AIP中的应用尚缺乏系统性报道和临床验证,但其在IgG4⁃RD中有一定的应用。阿巴西普是一种可溶性融合蛋白,由人CTLA4胞外结构域与人IgG Fc片段融合而成。其通过结合CD80/CD86,阻断其与CD28的相互作用,从而抑制T细胞活化。一项临床试验(NCT03669861)显示,皮下注射阿巴西普125 mg可使约半数IgG4⁃RD患者在未联合GC的情况下即获得良好疗效。Janus激酶(Janus kinase,JAK)抑制剂通过抑制JAK活性,从而阻断多种炎症信号通路,被认为在IgG4⁃RD中具有潜在治疗前景。目前多项针对IgG4⁃RD的JAK抑制剂临床研究正在进行,包括托法替尼(注册号:NCT05625581)、非戈替尼(注册号:NCT06285539)以及巴瑞克替尼(注册号:NCT05781516)。此外,还有其他多种小分子靶向药物也在临床试验中探索其在1型AIP中的潜在应用,包括靶向环氧酶⁃2的艾拉莫德(注册号:NCT03368274)、靶向新生儿Fc受体的艾加莫德(注册号:NCT07025330)、靶向布鲁顿氏酪氨酸激酶抑制剂的利扎布替尼(注册号:NCT04520451,NCT07190196)和泽布替尼(注册号:NCT04602598)以及靶向哺乳动物雷帕霉素靶蛋白的西罗莫司(注册号:NCT05746689)。抑制泛素⁃蛋白酶体系统的药物如硼替佐米及来那度胺在IgG4⁃RD中的应用也有相关研究。总体而言,尽管上述小分子靶向药物在IgG4⁃RD乃至1型AIP中的治疗潜力逐渐显现,但目前临床数据仍相对有限。
综上所述,对于1型AIP患者,GC应作为首选的一线治疗方案。对于复发高风险患者,可联合免疫调节剂进行维持治疗(可合并或不合并小剂量激素),未来的研究方向应着重于优化激素治疗策略。RTX可单药诱导AIP缓解,尤其适用于激素不耐受或激素抵抗的患者,对复发性1型AIP亦显示出良好的疗效与安全性。然而,其高昂的治疗费用在一定程度上限制了临床推广,且治疗过程中需密切监测药物相关感染风险。除RTX外,包括伊奈利珠单抗在内的多种单克隆抗体为1型AIP的治疗提供了新的选择,但其疗效与长期安全性仍需更多临床证据支持。与此同时,仍有多种候选药物正在进行注册临床试验,为未来的治疗策略拓展了可能。随着单细胞测序、蛋白质组学等多组学技术的广泛应用,人们对1型AIP发病机制的认识将更加深入,从而为筛选更具特异性的治疗靶点提供新的思路。此外,新型药物设计理念的引入,如双特异性抗体和蛋白降解靶向嵌合体等,也为实现更精准、更持久的治疗效果带来了新的契机。
参考文献
1.刘宗豪,周春华,邹多武.1型自身免疫性胰腺炎的药物治疗[J].中华胰腺病杂志,2025,25(5):321-326.DOI:10.3760/cma.j.cn115667⁃20251016⁃00149.
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)