近年来,与抗神经元表面蛋白抗体相关的脑炎正在日益受到关注,「自身免疫性精神病」和「自身免疫性
其中,最具代表性的疾病是抗N-甲基-D-天冬氨酸(NMDA)受体脑炎,它成为推动自身免疫性精神病和自身免疫性精神障碍概念的核心。抗NMDA受体脑炎的临床表现类似于原发性精神障碍,经常造成漏诊和误诊,但某些临床特征仍可提示其不同寻常之处。
一项近期发表于J Clin Invest.(影响因子13.6,Q1)的综述中,作者回顾了自身免疫性精神病概念的发展,并探讨了将其视为独立疾病实体的意义。篇幅所限,以下介绍该综述的部分内容,建议阅读文献原文(见文末文献索引)。

精神病性症状可以由多种潜在疾病引起,最常见的是精神疾病;其他疾病包括系统性自身免疫病或炎症性疾病、神经系统疾病(如遗传性疾病、神经退行性疾病、脑肿瘤、
值得注意的是,精神分裂症及相关疾病在炎症或自身免疫性疾病患者中更为常见,反之亦然,激起人们对免疫机制作为精神疾病潜在病因的研究兴趣。
免疫激活与精神疾病相关的最早证据可追溯至一个多世纪前;当时即有人提出,感染可以诱发行为及精神症状。另一方面,也有研究认为感染在精神疾病的治疗中具有潜力,如通过接种
二十世纪八十年代,很多关于免疫与精神障碍的研究聚焦于大脑对免疫功能的影响,如抑郁会削弱免疫反应。随后十年,动物与人类研究颠覆了这一观点,证明免疫激活可以影响脑功能。
多种环境因素,如感染、童年创伤和慢性应激,可通过升高促炎细胞因子参与精神障碍(包括精神分裂症、双相障碍、
全基因组关联研究和基因表达谱分析则发现,众多基因与罹患精神分裂症的风险相关,涵盖多种生物学通路,包括免疫功能(如HLA-DRB1、HLA-DQA1)、白细胞介素(如IL-1A、IL-6、IL-10)、突触可塑性与功能(
综上,随着时间的推移,针对精神分裂症及相关精神障碍的多条研究线索均指向遗传与环境因素在免疫通路、炎症、突触功能及NMDA受体等受体层面的相互作用。
2005年,一份个案报告描述了在四名年轻女性中观察到的、以初发精神病性症状和针对一种神经元细胞表面蛋白(后确认为NMDA受体)的自身抗体为特征的新型精神神经综合征。这一发现重新点燃了人们对自身免疫性精神神经障碍的兴趣。该病的关键特征包括:自身抗体为IgG类;靶向NMDA受体的GluN1亚基;在脑脊液中持续存在但在血中呈波动性出现,约15%的患者血清学检测阴性。
抗NMDA受体脑炎的年发病率估计为每百万人1.2-2例,具体因种族而异;主要累及儿童和青年,中位年龄约21岁,约70%的患者为女性;已知诱因包括肿瘤,最常见的是卵巢畸胎瘤,也包括
抗NMDA受体脑炎常以孤立的精神病性和行为症状起病,早期与原发性精神障碍难以区分。尽管大多数患者会在数天至数周内出现癫痫、异常运动或意识水平下降等神经症状,仍有5%-10%的患者全程主要表现为精神病性或行为改变,且病程早期常出现严重的
约80%的抗NMDA受体脑炎患者最终能实现较理想的康复,但病程迁延;功能性神经缺损和癫痫往往较早缓解,而认知及精神症状可持续数月。一项针对亚急性期患者进行的研究发现,如果未透露其近期的脑炎相关神经缺损病史,14%的患者曾短暂符合精神分裂症诊断标准。进一步分析显示,抗NMDA受体脑炎患者与精神分裂症患者在延迟反应任务中表现出相似的工作记忆缺陷。与年龄匹配的健康对照相比,既往刺激对两组患者工作记忆内容的影响均显著减弱。基于前额叶皮层微环路模型的计算模拟揭示,这一过程依赖NMDA受体,作用时间窗更长,机制较简单的兴奋/抑制调节更为复杂(如短时程增强)。
发现抗NMDA受体脑炎后,研究者很快又识别出其他针对多种突触受体或表面蛋白自身抗体的
表1 可出现精神病性症状的神经元抗体介导性脑炎
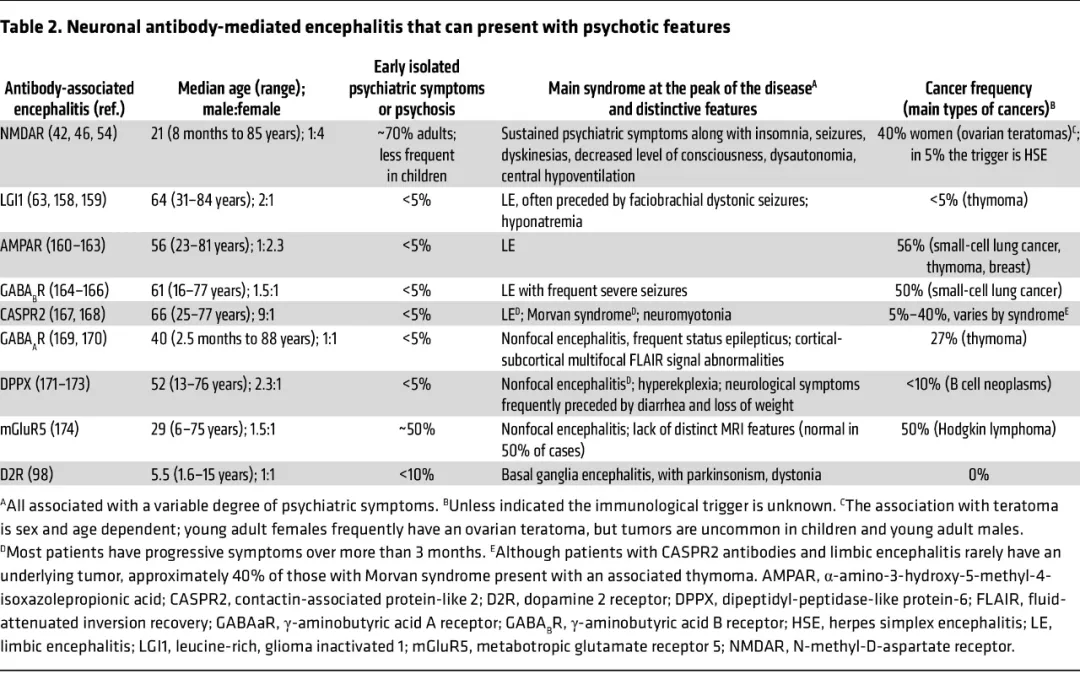
除抗NMDA受体脑炎之外,关注其他自身免疫性脑炎精神病性症状的研究很少。一项针对抗LGI1脑炎(第二常见的神经元抗体介导性脑炎)的研究发现,排除伴神经症状或缺乏核心精神病性特征(如幻觉、木僵)的病例后,46名患者中仅5例表现为孤立性精神病;这5例患者随后均出现神经功能缺损。另一项研究纳入152名通过免疫沉淀法检出抗体(该方法现已过时,但可识别部分LGI1抗体)的患者,其中5例出现视幻觉,3例出现妄想,但仅2例初诊为原发性精神障碍,且均伴有情感症状。其他类型自身免疫性脑炎中,精神病性症状较罕见,且多为个案报告。综上,以阳性及阴性精神病性症状为主的精神表现,以及对NMDA受体的特异性攻击,使抗NMDA受体脑炎有别于其他类型的自身免疫性脑炎。
抗NMDA受体脑炎的神经病理学研究显示,患者脑内可观察到轻至中度B细胞与
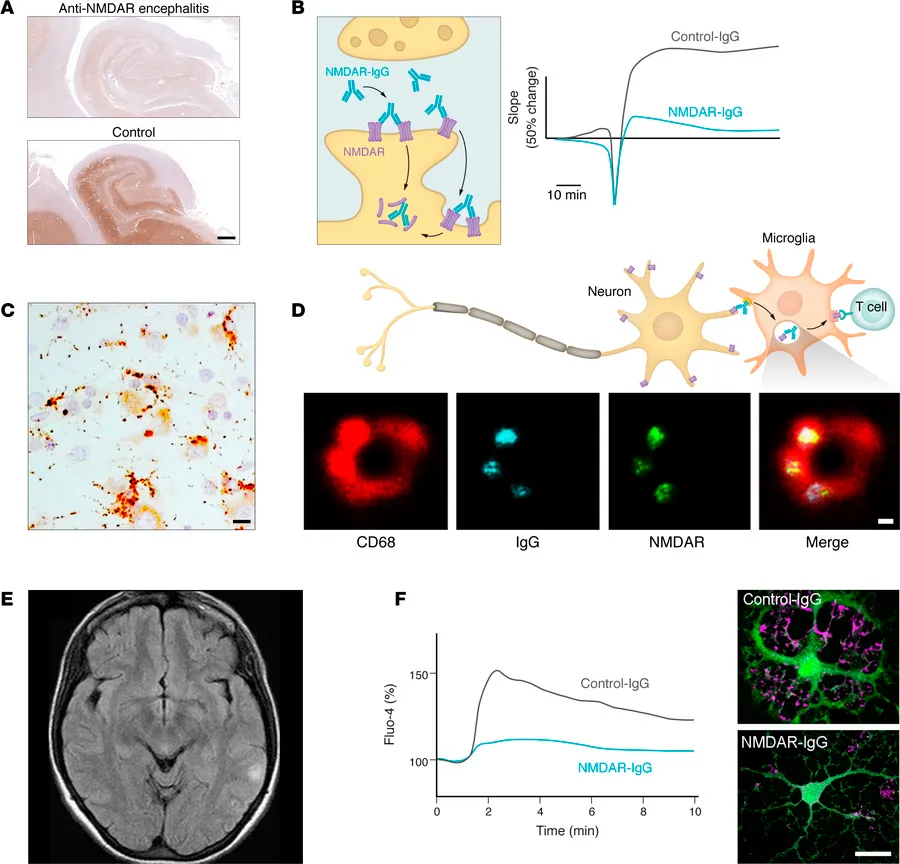
图1 NMDA受体自身抗体对神经元与突触网络、小胶质细胞及白质的影响;(A) 抗NMDA受体脑炎患者尸检海马(上图)与对照海马(下图)相比,使用特异性生物标志物(棕色免疫染色)检测到的NMDA受体表达显著减少。(B) 实验研究表明,抗体交联并内化NMDA受体(左图),与对照IgG相比破坏长时程增强(右图),并伴随NMDA受体依赖网络功能受损。(C) 患者神经病理研究一致观察到小胶质细胞激活,HLA-DR染色所示。(D) 实验模型显示,激活的小胶质细胞内吞结合NMDA受体的IgG(上图),受激发射损耗(STED)超分辨显微镜证实内体(CD68)、IgG与NMDA受体的GluN1亚基共定位(下图)。小胶质细胞可能处理内化后的NMDAR,促成表位扩展及多克隆抗体反应,该过程可能发生于深颈淋巴结(未显示)。(E)抗NMDA受体脑炎患者的MRI显示左侧顶叶FLAIR信号轻度增高。(F)尽管抗NMDA受体脑炎患者的MRI常无明显异常,但来自培养少突胶质细胞的实验数据显示,患者抗体(而非对照IgG)可损害NMDA受体介导的钙电流(左),进而导致GLUT1表面表达减少(右;GLUT1以粉色显示),这可能是高级神经影像(如弥散张量成像)常观察到白质异常的原因之一。GLUT1,
多巴胺、谷氨酸、5-羟色胺在精神病中的作用早已通过药理学模型得到证实。已知精神兴奋剂、解离性麻醉剂和迷幻剂分别可以诱发不同的精神病性症状,例如,可卡因和苯丙胺等精神兴奋剂可增加多巴胺释放和D2受体刺激,通常导致听幻觉和被害妄想;苯环利定和
除观察到不同药物可诱发各异的精神病性症状外,人们也认识到,源于神经或精神疾病的精神病性症状在临床表现上存在差异。例如,与多巴胺能亢进相关的听幻觉和被害妄想见于精神分裂症,而
抗NMDA受体脑炎的精神病性特征与NMDA受体功能低下/谷氨酸假说的吻合度高于多巴胺或5-羟色胺模型。表2总结了可用于鉴别抗NMDA受体脑炎相关精神病性症状的临床背景及关键特征(SEARCH For NMDAR-A):
表2 抗NMDA受体脑炎的诊断线索

临床需要怀疑抗NMDA受体脑炎的临床表现包括:无前驱期;阴性与阳性症状并存;严重激越与紧张症特征在数分钟至数小时内显著波动;躁狂行为;对抗精神病药物(尤其是第一代抗精神病药)频繁不耐受。失眠和认知缺陷尽管也可见于精神分裂症,但在抗NMDA受体脑炎中往往异常严重。很多患者出现性方面的脱抑制,并伴有夸大、宗教、牵连或被害妄想。高热、肌强直、意识水平下降、肌酸激酶升高及横纹肌溶解都是恶性综合征的常见表现,但也可能发生在从未使用过抗精神病药的患者中。
「自身免疫性精神病」这一标签之下,并不存在一种独立的自身免疫性精神疾病,甚至综合征。这一概念存在三个关键的局限性,每一个都对准确诊断和有效治疗具有重要影响:
首先,之所以出现「自身免疫性精神病」这样一个宽泛的概念和标准,根源在于缺乏一类独立的、由自身抗体驱动的精神疾病实体。为涵盖更多情况,这些标准纳入了多种自身免疫性或副肿瘤性脑炎的神经系统症状和共病,最终形成了一个依赖脑脊液抗体检测兜底的框架。然而,在提出这些标准时,相关病例系列研究中的脑脊液数据极为稀缺,支持证据几乎为零。后续研究表明,临床极少针对精神病患者检测脑脊液中的神经元自身抗体;即便检测,结果也通常为阴性,除非自身免疫性脑炎的表现已经极为明显。这些标准的敏感性也很有限,会漏诊以精神病性症状为表现的较为确切的抗NMDA受体脑炎病例。
其次,精神病性症状可以由多种生物学通路引起,每种通路可能需要不同的治疗方法。其中一些类型可能对抗精神病药有反应,而另一些在抗精神病药治疗后则可能恶化。这些差异不仅适用于非自身免疫性精神病,也适用于自身免疫性脑炎中的精神病性症状。尽管抗NMDA受体脑炎中的精神病性症状及其他精神症状已得到了较好的记录,但其他自身免疫性脑炎的症状谱仍基本未知;其潜在机制,无论是多巴胺能、谷氨酸能还是5-羟色胺能,同样尚不清楚,导致药物治疗更加复杂。例如,在抗NMDA受体脑炎中,NMDA受体功能低下可能是精神病性症状的生物学基础,此时苯二氮䓬类药物的耐受性良好,而抗精神病药的耐受性则不理想。然而,这些药物对其他自身免疫性脑炎所致精神病性症状的影响尚不明确。
第三,临床术语遵循层级结构,定义明确的疾病(如抗NMDA受体脑炎、抗LGI1脑炎、SLE)代表具体诊断,而更宽泛的综合征和症状(如自身免疫性精神病)可横跨多种疾病,诊断特异性低。如果依据非特异性症状重新分类不同疾病,或按共有特征(如精神病性症状)将其归为一类,会形成病理生理学、合并症、治疗及预后各异的异质性队列。例如,有研究者将确诊的抗NMDA受体脑炎患者与原发性精神障碍伴偶然的、临床意义不明抗体的患者进行合并分析,这种聚合会妨碍数据解读,延误治疗,并增加了试验入组的复杂程度。
一项纳入164例被归类为「可能或确诊自身免疫性精神病」患者的研究中,上述局限性得到了体现:119例检出神经自身抗体的患者中,118例为抗NMDA受体脑炎,1例为抗LGI1脑炎;另外45例患者中,3例为神经精神狼疮,42例缺乏免疫学特征,具体诊断不明。与抗NMDA受体脑炎患者不同,这42例未分类患者临床表现多样,可能涵盖更广泛的自身免疫、炎症或其他疾病谱。部分患者死亡后,因早期被贴上「无NMDA受体抗体的自身免疫性精神病」标签,导致后续免疫学评估受限,造成疾病漏诊。
自身免疫神经病学领域中,曾经出现过「自身免疫性癫痫」的概念。与「自身免疫性精神病」类似,早期提出的自身免疫性癫痫将多种预警信号一股脑纳入,经常将症状性癫痫发作错误地视为癫痫这一疾病。必须区分基础疾病并使用准确术语(症状性癫痫发作 vs. 癫痫),因为这关系到治疗决策、社会与职业转归,大多数自身免疫性脑炎患者也并不会发展为典型的癫痫。类似顾虑也出现在所谓的「自身免疫性强迫症」「自身免疫性抑郁」「自身免疫性运动障碍」「自身免疫性痴呆」等术语上,它们与「自身免疫性精神病」「自身免疫性癫痫」一样,很容易将综合征上升为主要诊断。
目前一个优先级较高的研究事项,是提高对自身免疫性精神症状作为特定自身免疫性脑炎(尤其是抗NMDA受体脑炎)表现的识别。这需要采取有针对性的方法,将全面的神经和精神评估与血清及脑脊液分析相结合,并辅以其他检查(脑电图、脑部 MRI),以揭示潜在的脑炎或新型自身免疫性精神疾病。应特别关注那些精神病首次发作、没有或几乎没有神经症状、但与精神分裂症表现不甚相符的患者;此时应考虑其他诊断,尤其是抗NMDA受体脑炎。这些临床表现不典型的患者,以及无论最初精神科表现如何,但对抗精神病药无反应或不耐受的患者,均应接受神经科会诊,并完善脑电图、脑部MRI和脑脊液检查。不推荐采用先检测血清抗体、仅在阴性时再检测脑脊液的顺序策略,因为仅检测血清存在假阳性风险,并可能漏诊血清抗体阴性的病例。
另一个重点是避免不加选择地进行抗体检测,尤其是那些在健康人群中也可能出现或在特定疾病背景外意义不明的抗体,如ANA、TPO、Zic4、recoverin、低滴度 GAD、CDR2,因为它们经常干扰诊断,尤其是在缺乏对照数据时。临床相关抗体(如 GluN1/NMDAR)被不恰当地检测时,也会出现类似问题,例如仅使用血清进行基于细胞的检测(CBA)而未通过其他试验或脑脊液分析确认。这些做法可能造成误诊,导致患者接受不必要的免疫治疗,而他们其实更适合接受标准的精神科治疗。
抗NMDA受体脑炎及其他自身免疫性脑炎中,抗体通常针对传统ELISA无法检测的构象表位,使得ELISA研究结果的临床意义不确定。鉴于某些抗体和检测方法的局限性,临床意义不明的检测不应单独使用;对于前测概率低的患者,应避免检测或谨慎解读结果,正如针对符合多发性硬化诊断标准的患者不推荐单独检测MOG-IgG一样。在精神病患者中,前测概率低的情况包括已确诊的慢性精神疾病,或缺乏神经系统表现、且无自身免疫性脑炎(尤其是抗NMDA受体脑炎)合并症的急性精神病。如果出现非典型表现,尤其是表2所列特征,应进一步加以评估,包括脑脊液分析。
除临床意义外,自身免疫性脑炎也是连接神经科与精神科的桥梁。这些疾病患者的自身抗体有望成为强有力的研究工具,揭示针对突触靶点的免疫攻击如何引发精神病性症状及复杂的神经精神症状,其间所获得的洞见可能有助于发现仅以孤立精神症状为表现的新疾病。目前研究者仅建立了抗NMDA受体脑炎的主动免疫模型,但结合临床研究,类似方法有望推进对类似疾病神经生物学与免疫生物学的理解。这些模型或有助于阐明疾病机制,并支持开发免疫疗法之外的治疗手段,例如靶向突触受体的变构调节手段。
2019-10-27
文献索引:Cabrera-Maqueda JM, Planagumà J, Guasp M, et al. Autoimmune neuropsychiatric disorders manifesting with psychosis. J Clin Invest. 2025 Oct 15;135(20):e196507. doi: 10.1172/JCI196507. PMID: 41090356; PMCID: PMC12520689.
点击「阅读原文」可查看及检索历史文章。

(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)