概述
病因和流行病学
AOSD与全身型
AOSD 全球发病率约为 (0.16~0.4)/10 万,患病率 (0.73~6.77)/10 万。常为中青年发病,20~40 岁发病率最高,约占 70%,有两个发病高峰,15~25 岁和 36~46 岁,但 60 岁以后起病者并不罕见,约占 7%~10%。女性发病率可能稍高于男性。AOSD 是临床上发热待查的主要病种之一,占不明原因发热患者的 10%~20%。
临床表现
发热、关节症状、皮疹,常被称为 AOSD 的三联征。
发热是 AOSD 最常见的临床表现,存在于 84.7%~100% 的患者。典型的热型呈弛张热,通常傍晚或夜间体温开始上升,迅速达到或超过 39℃,伴或不伴寒战,部分患者不经退热数小时后体温可自行降至正常,热退后活动自如,一般每日一次热峰,偶有两个热峰。每日发热持续时间大于 1 周以上。发热可以是 AOSD 早期唯一的临床症状,因此当遇到不明原因发热的患者时,要考虑到 AOSD 的可能。
关节痛或关节炎是本病第二常见症状,存在于 40%~100% 的患者,可为多关节或单关节炎,往往病初较轻,此后受累关节逐渐增多、程度逐渐加重。关节症状与发热有一定相关性,发热时加重、热退后减轻。可以累及任意关节,膝、腕、踝、肘、近端指间关节最常累及。部分患者可进展为对称性的多关节炎,和类风湿关节炎相似。关节液分析显示白细胞增多 (>2000/mm³),中性粒细胞占 40%~95%。如行滑膜活检,病理呈非特异性滑膜炎。随着疾病的进展,约 1/3 的患者会出现关节破坏。双侧腕关节强直,而无掌指关节或近端指间关节的结构性损伤,高度提示 AOSD 的诊断。
皮疹是本病的另一个主要表现,约见于 51.8%~87.1% 的患者。典型的特征性皮疹为一过性不痛不痒的三文鱼色 (橙红色) 斑疹或斑丘疹,主要分布于躯干或肢体近端,偶可见于面部、手足掌。皮疹与发热相伴随,热起疹出,热退疹消。典型皮疹的病理提示非特异性炎症,真皮浅层及血管周围轻度多种炎细胞浸润,但无明确
AOSD 患者其他常见的临床表现包括:肌痛、咽痛、肝脾淋巴结肿大。AOSD 患者中 56.2%~83.9% 有肌痛主诉,往往与发热相关,肌力一般不受影响,多不伴有肌酶升高和
并发症方面,巨噬细胞活化综合征 (MAS) 是 AOSD 最重要的严重并发症,可危及生命,发生率为 12%~15%。AOSD 其他并发症相对少见,包括血栓性微血管病、
传统上,AOSD 的临床病程可分为单发型、多发型及慢性型。单发型,占患者总数的 19%~44%,指病程超过 2 个月但不到 1 年,为自限性,可达到无药物缓解。多发型,占 10%~41%,指经治疗病情缓解后数月 (>2 个月) 至数年疾病再次发作。慢性型,存在持续性的炎症,常导致慢性侵蚀性关节炎,早期研究中占 35%~67%,但随着靶向治疗的应用,已减少至占 22.7%。近年来,有学者提出根据患者发病时的主要临床表现将 AOSD 分为系统型和关节炎型,系统型以发热及全身症状为主要表现;关节炎型以关节炎为主要临床表现,全身性症状较轻,易进展为慢性侵蚀性关节炎。这种分型,对于治疗方案的选择和预后的判断,有一定指导意义。
辅助检查
AOSD 作为一种排除性诊断,目前尚无具有诊断特异性的检查,患者需要完善大量检查,一方面评估 AOSD 的病情活动程度及并发症的有无,一方面排除其他发热性疾病。
常规实验室检查:血、尿、
诊断
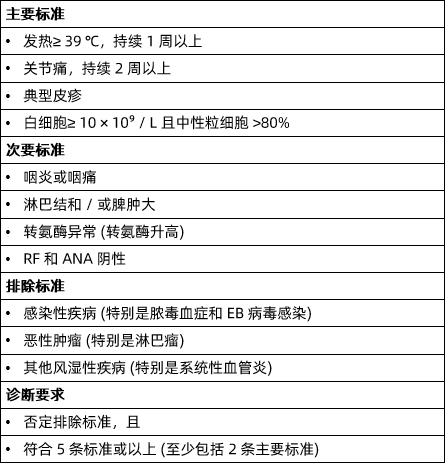
鉴别诊断
AOSD 患者多以不明原因发热为主诉,应遵循不明原因发热的鉴别诊断思路,与感染、肿瘤及其他系统性疾病相鉴别。
感染性疾病:细菌、真菌、病毒、寄生虫感染,特别是感染灶隐匿的深部软组织及脏器脓肿、感染性心内膜炎、结核、布鲁氏菌病、EB 病毒感染等。
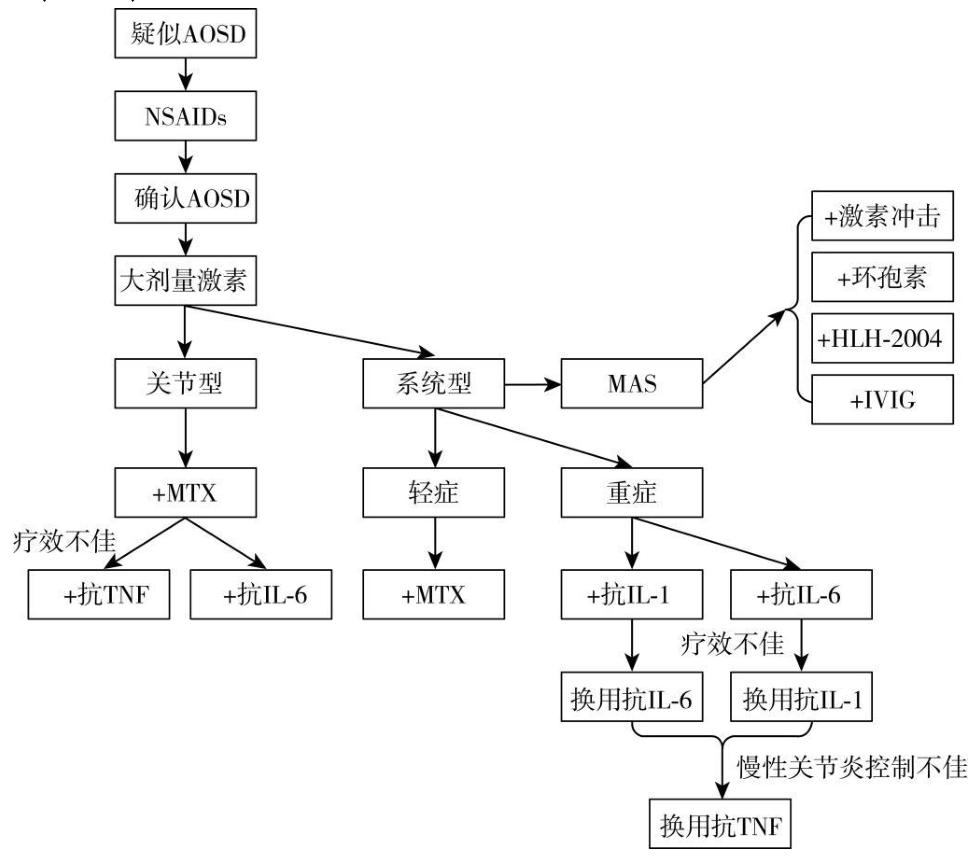
治疗
并发症监测
AOSD 最重要的并发症是 MAS。当 AOSD 患者出现持续高热、明显脾大、血二系或者三系下降、肝损加重、纤维蛋白原下降、铁蛋白极度升高时,要高度警惕 MAS 的发生。诊断可依据 2004 年噬血细胞性淋巴组织细胞增多症 (HLH) 的临床诊断标准、2016 年 MAS 分类标准或 M 评分、H 评分,但应结合医生的临床判断,不能拘泥于严格满足标准。当 AOSD 患者出现 MAS 时,还有要除外继发感染所诱发,特别是病毒感染。MAS 的初始治疗,泼尼松通常增加到大于 1mg/(kg・d),往往需要激素冲击治疗,联合环孢素,可考虑应用静脉注射免疫球蛋白 (IVIG)。可参照 HLH-2004 治疗方案,给予地塞米松联合
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)