✦
•
✦
欧洲肾脏协会(ERA)年会于2025年6月7日在奥地利维也纳圆满落幕。在本次大会上,
✦
•
✦
付平 教授
四川大学华西医院
二级教授/主任医师,博士/博士后合作导师,四川大学华西医院肾脏内科主任/华西肾脏病研究所所长,国际肾脏病学者(ISN Scholar),《中华医学杂志英文版》等23种杂志编委;国家重点研发计划等28项课题负责人,以第一作者和通讯作者发表论文400余篇,其中SCI收录160余篇,包括JASN,Cell research,STTT,Nat Commun等国际著名期刊;主编人民卫生出版教材和专著各一部;中华医学会科技进步二等奖,华夏医学科技进步二等奖及四川省科技进步一等奖各一项;国家发明及实用新技术专利46项,转化13项,其中一项2016年进国家基本医保目录,软著7项,转化5项。
-中华医学会肾脏病学分会8、9、10届常委;
-中国医师协会肾脏内科分会常委;
-中国医院协会血液净化中心分会副主任委员;
-中国中药协会肾病中药发展研究专委会主任委员;
-中国中西医结合学会基层工作委员会候任主任委员;
-中国药理学会肾脏药理专委会常委;
-四川省医学会肾脏病专委会主任委员;
-四川省医师协会肾脏内科医师分会会长;
-四川省国际医学交流促进会肾脏分会会长。
从源头减少免疫复合物产生,靶向APRIL药物迎来新突破
IgAN病理机制复杂,目前较为公认的是“四重打击”学说,循环中Gd-IgA1的产生增加是第一重打击[1]。B细胞的两种生长因子即APRIL和BAFF,通过促进B细胞活化和Gd-IgA1的生成,在IgAN的启动中具有重叠但不同的作用[2]。APRIL通过与B细胞成熟抗原(BCMA)及跨膜激活子和钙离子信号调节亲环素配体(CAML)相互作用蛋白(TACI)结合,参与B细胞活化、增殖和类别转换,进而促进Gd-IgA1的产生[3]。BAFF除了与BCMA、TACI结合外,还可与未成熟B细胞上的受体BAFF-R特异性结合,有助于B细胞成熟,促进外周B细胞激活、存活和分化,维持B细胞稳态,并支持B细胞生存和分化为长寿
随着研究的不断深入,与之相关联的特异性治疗靶点药物也引起高度重视。本次大会公布了多项靶向APRIL的IgAN药物研究进展,包括首个针对APRIL的人源化IgG2单克隆抗体—斯贝利单抗(Sibeprenlimab;VIS649),以及针对性抑制APRIL和B细胞激活因子(BAFF)双靶点的
斯贝利单抗Ⅲ期VISIONARY研究是迄今为止规模最大的 III期IgAN试验,旨在深入全面地评估每4周一次皮下注射(SC)400 mg斯贝利单抗对IgAN患者的疗效和安全性。结果显示,研究达到主要终点,治疗9个月后,斯贝利单抗组的uPCR-24h相较于基线降低50.2%,安慰剂组的uPCR-24h相较于基线升高2.1%;与安慰剂组相比,斯贝利单抗组的uPCR-24h显著降低51.2%(P<0.0001)(图1)。斯贝利单抗组治疗期间出现的任何不良事件(TEAEs)的受试者比例为76.3%,而安慰剂组为84.5%,无死亡事件报告,提示该药物具有良好安全性[4]。
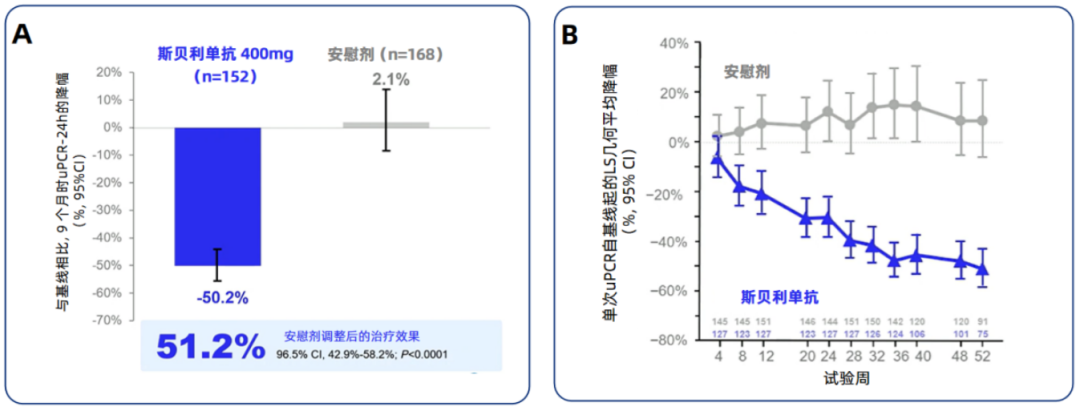
图1. VISIONARY研究中期分析主要终点结果
此外,会上针对APRIL/BAFF双靶点药物,包括泰它西普和Atacicept也发布了最新研究。其中一项系统综述和Meta分析表明,与对照组(标准治疗或安慰剂治疗)相比,泰它西普组治疗24周的24小时尿蛋白水平显著降低(MD:-0.51;95%CI:-0.84,-0.17;P=0.003;I²=11%),两组间eGFR保持稳定,且不良事件发生率无显著差异[5]。另一项针对Atacicept的ORIGIN Ⅱb期研究则证实,停止该药物治疗后第12周和26周血清Gd-IgA1水平分别增加90%和117%,eGFR分别降低1.6mL/min/1.73m²和3.9mL/min/1.73m²。研究结果提示坚持Atacicept治疗IgAN具有潜在临床获益[6]。
除探索靶向APRIL和APRIL/BAFF药物治疗IgAN患者疗效和安全性的研究外,本次大会也发布了此类药物对免疫稳态影响的研究结果,或许能为后续临床研究和实践提供参考。
APRIL和APRIL/BAFF抑制对免疫稳态的影响具有差异,未来仍需进一步探索
虽然抑制APRIL或APRIL/BAFF已成为具有前景的IgAN疗法,但它们对免疫稳态的更广泛影响仍未完全了解。本次ERA年会发布的一项动物研究,在小鼠模型中表征了APRIL和APRIL/BAFF抑制对免疫细胞群、血清学反应和保护性免疫的不同影响。小鼠每周两次接受抗APRIL抗体(4540)或APRIL/BAFF抑制剂(TACI-Fc融合蛋白POV和ATA,分别基于Povetacicept和Atacicept的序列)或同型对照抗体(MOTA)的处理。每周通过酶联免疫吸附测定(ELISA)定量检测血清免疫球蛋白(IgA、IgM和IgG)水平。在初次给药后的第8周,对小鼠脾脏中分离的脾细胞进行了全面的免疫表型分析,以表征B细胞和T细胞群体。此外,还对小鼠脾细胞进行了单细胞RNA测序和空间转录组学分析。结果显示,除了脾生发中心B细胞外,对小鼠反复给予抗APRIL单抗4540并未显著减少B细胞或抗体分泌细胞(ASC)亚群;相反,两种双重APRIL/BAFF抑制剂均导致总体B细胞(最多达89%)和大多数B细胞亚群的减少,包括ASC(图2A)。滤泡B细胞经APRIL/BAFF抑制剂处理后数量减少,并表现出较低的CD21/35表达(图2B),表明其成熟和增殖潜力受到抑制。APRIL和APRIL/BAFF抑制对大多数T细胞群的影响较小。双重APRIL/BAFF抑制剂则导致T滤泡辅助细胞(Tfh)数量减少,这一观察结果与BAFF促进Tfh细胞发育一致(图2A)[7]。
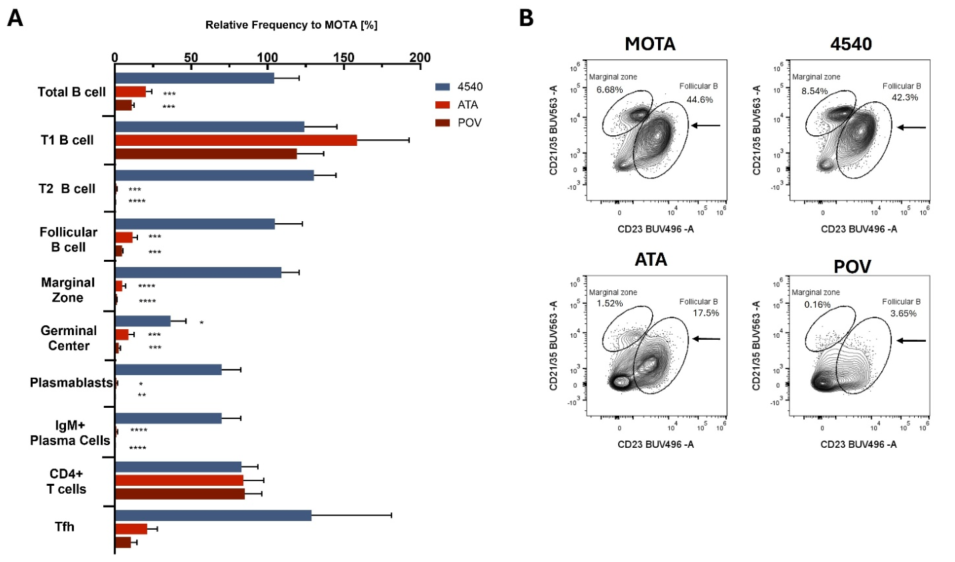
图2 A. 流式细胞术分析MOTA、4540、ATA或POV处理小鼠(每组n=5;ATA组n=4)后的B细胞和T细胞群。数据表示相对于MOTA,不同处理组每种亚型细胞的平均数量。误差条表示均值的标准误差(SEM)。*P< 0.05,**P< 0.01, ***P<0.005,****P<0.001代表与MOTA进行单因素方差分析比较的结果。B. 小鼠脾脏滤泡B细胞中CD21/35表达的流式细胞术等高线图;百分比表示每个亚型中CD45+细胞的比例。
对同一批经处理的小鼠进行血清学检测表明,APRIL和APRIL/BAFF抑制剂均使IgA水平降低了≥40%。APRIL/BAFF抑制剂还使IgM和IgG分别降低了≥60%和≥20%,而单独抑制APRIL并未降低IgM或IgG水平(图3)[7]。
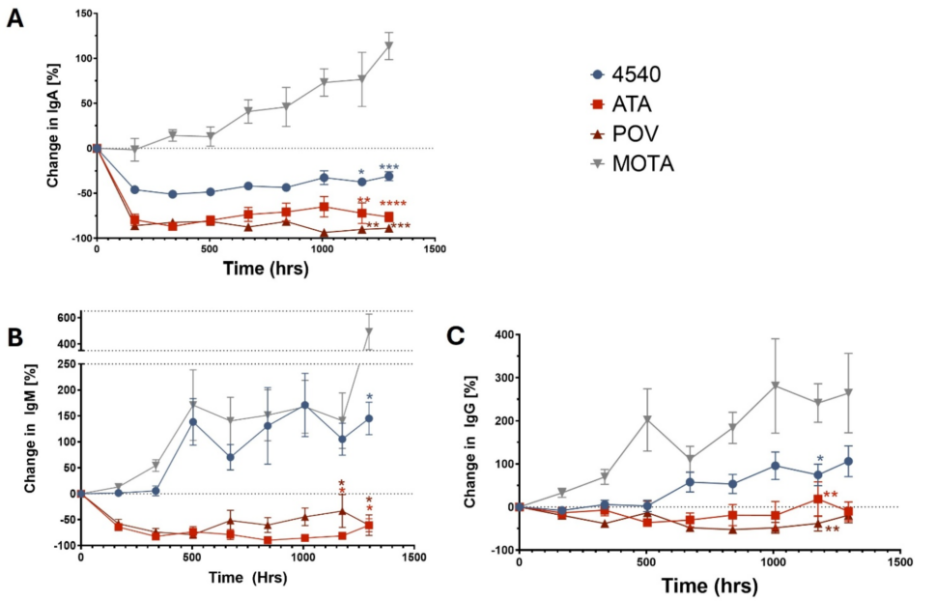
图3. 同一批动物不同处理组A. IgA;B. IgM;C. IgG水平的检测结果。数据表示相对于治疗前Ig浓度的变化。误差条表示均值的标准误差(SEM)。对最后两个时间点与MOTA处理组的比较进行了Geisser-Greenhouse校正的混合效应统计分析:*P< 0.05,**P< 0.01,***P< 0.005,****P< 0.001。
该研究证明,使用APRIL抑制剂和APRIL/BAFF双重抑制剂能够减少血清IgA水平,这对于IgAN等肾脏疾病来说是一个理想的效果。然而,APRIL/BAFF双重抑制会导致大多数B细胞亚群、ASCs和Tfh显著减少,而单独抑制APRIL则不会显著改变脾脏细胞群体。广泛的免疫细胞减少对免疫稳态以及对疫苗和病原体的免疫反应都有潜在影响。正在进行的动物研究将把对APRIL和APRIL/BAFF抑制的分析扩展到多种疫苗和病毒挑战模型中[7]。
总结
《2024版KDIGO IgA肾病和IgA血管炎临床管理实践指南》强调,lgAN的治疗需尽早启用减少lgA及lgA免疫复合物的药物,从发病机制源头上尽早控制疾病活动[8]。鉴于APRIL在促进Gd-IgA1生成中的重要作用,靶向抑制APRIL成为IgAN的关键对因治疗策略。目前首个针对APRIL靶点的斯贝利单抗已获得FDA授予的突破性疗法认定,未来或可成为治疗IgAN的重点药物。
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)