前言
脑转移是
然而,该药在“吡咯替尼经治”这一特定临床场景中的疗效与安全性,特别是针对中国患者群体的数据,仍缺乏充分证据。为此,一项发表于《Scientific Reports》的研究[6]对15例此类患者进行了回顾性分析,旨在为我国临床实践提供真实世界的循证医学证据。
研究方法
本研究为一项单中心回顾性队列研究,通过电子病历系统筛选出接受T-DXd治疗的转移性乳腺癌患者。关键入组标准包括:(1) 年龄≥18岁;(2) 病理诊断为HER2阳性乳腺癌 (3) 经影像学证实存在脑转移;(4) 既往基于吡咯替尼的治疗期间出现脑转移进展(新发脑转移或既有脑转移进展)。
T-DXd推荐剂量5.4 mg/kg,每21天静脉输注一次。治疗持续至疾病进展、出现不可耐受的毒性或任何其他原因。研究主要终点为中枢神经系统无进展生存期(CNS-PFS),次要终点包括颅内、颅外及总体病灶的客观缓解率、临床获益率;总生存期(OS);以及安全性。
研究结果
患者特征
2021年4月至2023年7月期间,共纳入了15例既往接受过吡咯替尼治疗并出现疾病进展的HER2阳性脑转移乳腺癌患者。15例患者的中位年龄为51岁(范围:32-66岁),5例患者激素受体呈阳性。共有14例患者同时存在颅外转移和颅内转移。转移部位的中位数为5个(范围:1-6)。在转移性疾病阶段接受T-DXd治疗前,既往治疗线数的中位数为6线(范围:2-11)。所有患者均既往接受过曲妥珠单抗和吡咯替尼治疗,13例患者(86.7%)接受过
在确诊脑转移后,13例患者(86.7%)接受了曲妥珠单抗联合帕妥珠单抗治疗,8例患者(53.3%)接受了吡咯替尼治疗,5例患者(33.3%)接受了T-DM1治疗。在确诊脑转移后、接受T-DXd治疗前,抗HER2治疗线数的中位数为2线(范围:0-5)。
疗效
截至2023年9月,中位随访时间为8.6个月(范围:2.1-23.3个月)。5例患者继续接受T-DXd治疗,10例患者因疾病进展中止治疗,其中6例出现颅内和颅外同时进展,4例仅出现颅外进展。8例患者(57.1%)因乳腺癌进展死亡。中位CNS-PFS为7.4个月(95% CI 6.1-8.8个月)(图1A),伴有颅外病灶和所有病灶患者的中位PFS均为6.4个月(95% CI 4.4-8.3个月)(图1B),中位OS为9.8个月(95% CI 5.9-13.8个月)(图1C)。
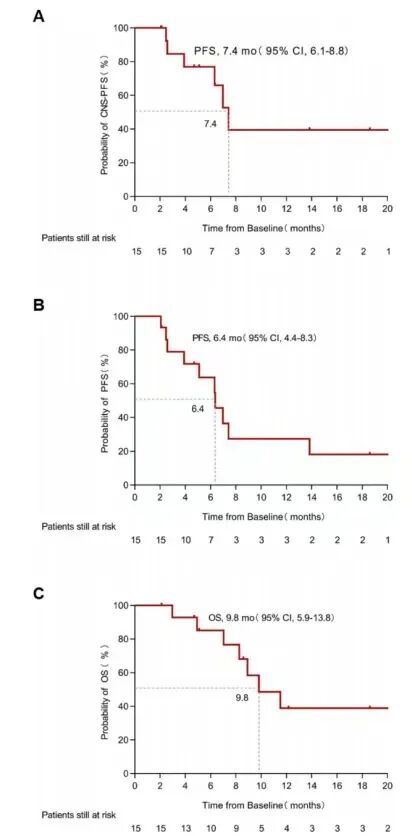
图1 K-M分析 (A) 15例患者的CNS-PFS(B) 伴有颅外/全部病灶患者的PFS (C) 15例患者的OS
在研究纳入的15例患者中,9例有可评估的颅内病灶,14例有可评估的颅外病灶。颅内、颅外和总体病灶的客观缓解率分别为33.3%(3/9)、71.4%(10/14)和73.3%(11/15),而颅内、颅外和总体病灶的临床获益率分别为53.3%、66.7%和73.3%。颅内病灶、颅外病灶和总体病灶的中位至缓解时间分别为1.5个月、1.4个月和1.6个月,而中位缓解持续时间分别为4.9个月、5.7个月和6.0个月(图2)。
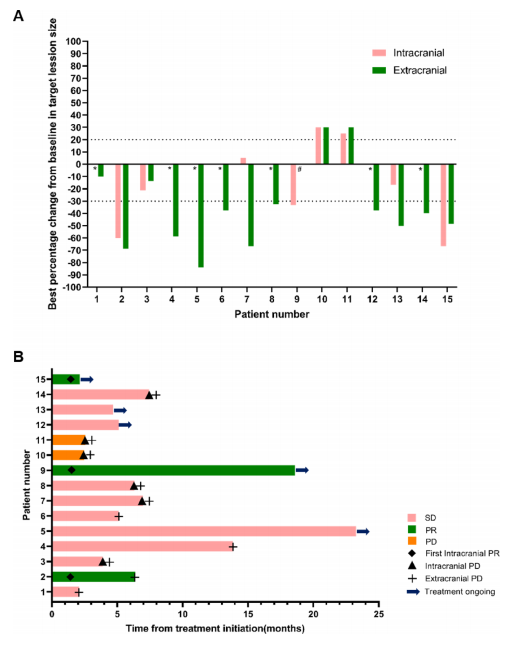
图2 肿瘤反应。(A) 15例患者颅内和颅外靶病灶相对基线最佳变化的瀑布图 (B) 15例患者无进展生存期的游泳图
安全性
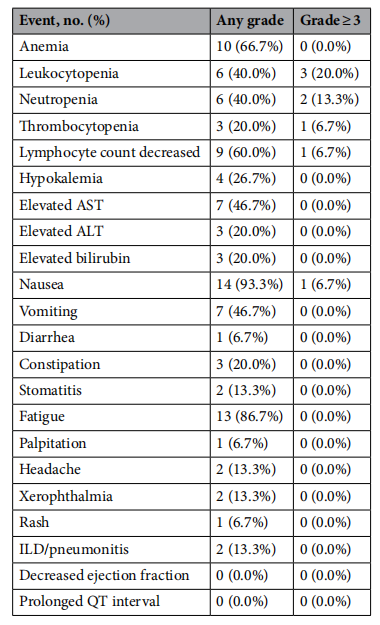
治疗中出现的不良事件(发生率≥5%)如表1所示,其中大多数为1/2级,因此可控。发生率>5%的3级或以上不良事件包括
表1 发生率≥5%的治疗中出现的不良事件(n = 15)
小结
本回顾性研究初步证实,在中国临床实践中,对于吡咯替尼治疗后进展的HER2阳性乳腺癌脑转移患者,T-DXd是一种可选的治疗方案,展现出良好的颅内及颅外抗肿瘤活性与可控的安全性。尽管本研究存在样本量有限、选择偏倚及随访时间短等局限性,但它首次为该特定临床场景提供了疗效与安全性的初步证据。T-DXd在此类患者中的确切疗效及其在治疗序列中的定位,仍需未来更大规模的前瞻性研究予以明确。
审批编号:CN-175223
有效期至:2026/12/27
本文由阿斯利康提供,仅供医疗卫生专业人士参考,不可用于推广目的
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)