T细胞
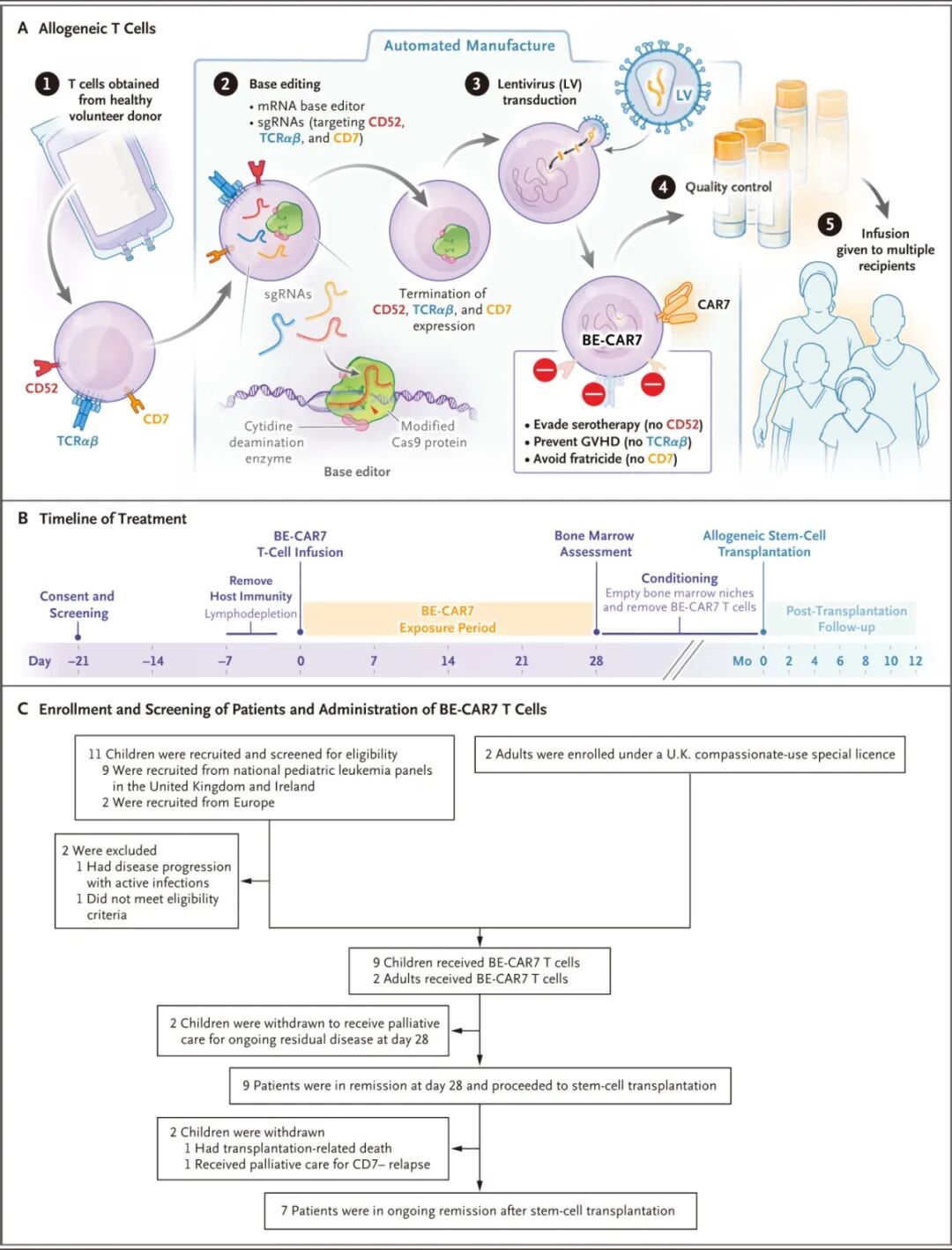
因此学者开展研究,采用碱基编辑(base editing)技术,通过CRISPR系统精准敲除CD7、TCRαβ和CD52,制造通用型(universal)异体碱基编辑的CAR7 T细胞(BE-CAR7),避免GVHD(
研究类型:I期临床试验
研究对象:9名儿童(6个月–16岁);2名成人(通过英国同情用药通道入组);均为复发/难治性CD7+ T-ALL
治疗方案:先进行淋巴清除(
疗效结果:
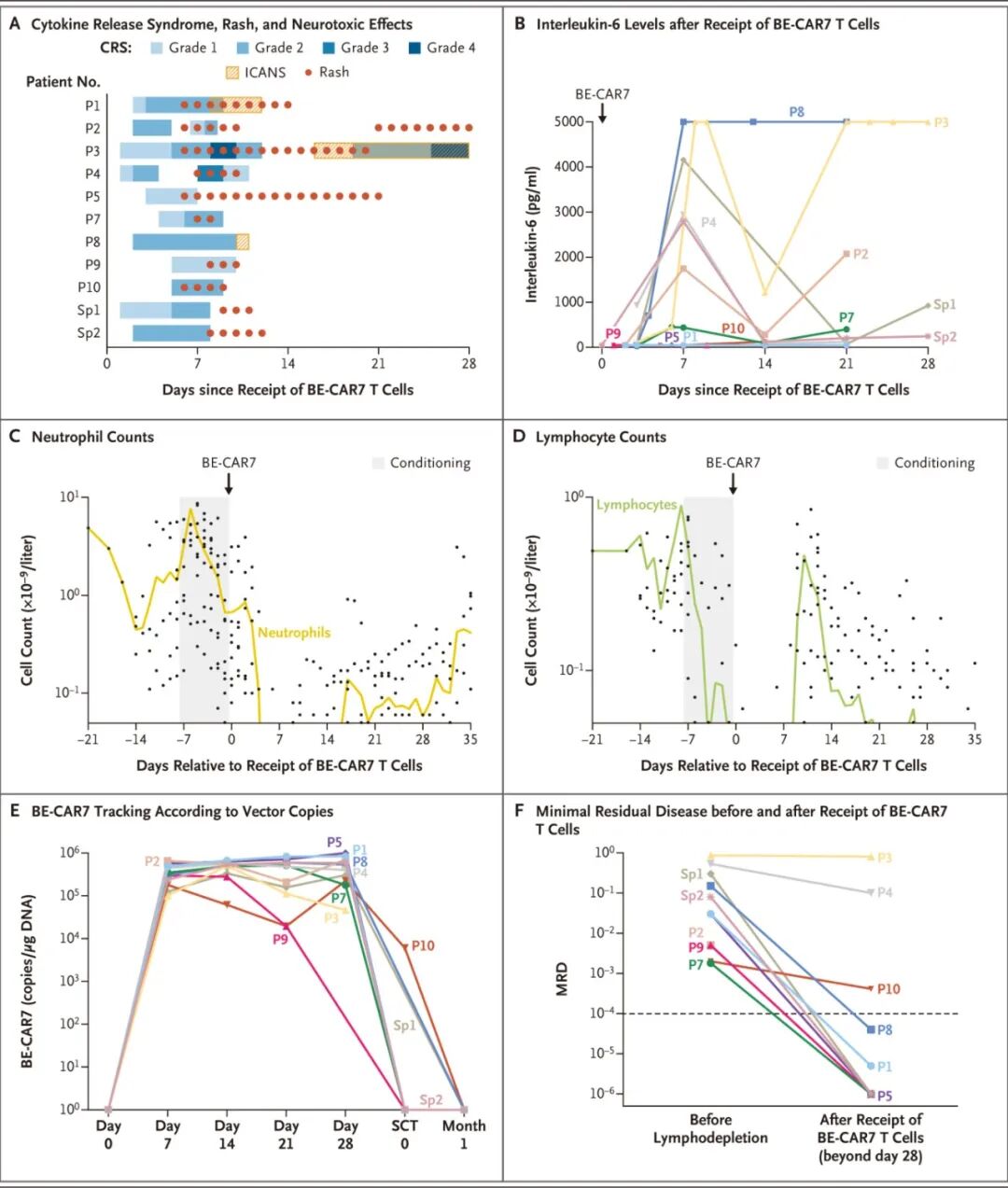
所有11名患者均在第28天达到形态学完全缓解(伴有不完全计数恢复)。
其中9名患者(82%) 达到深度缓解,得以继续进行干细胞移植。
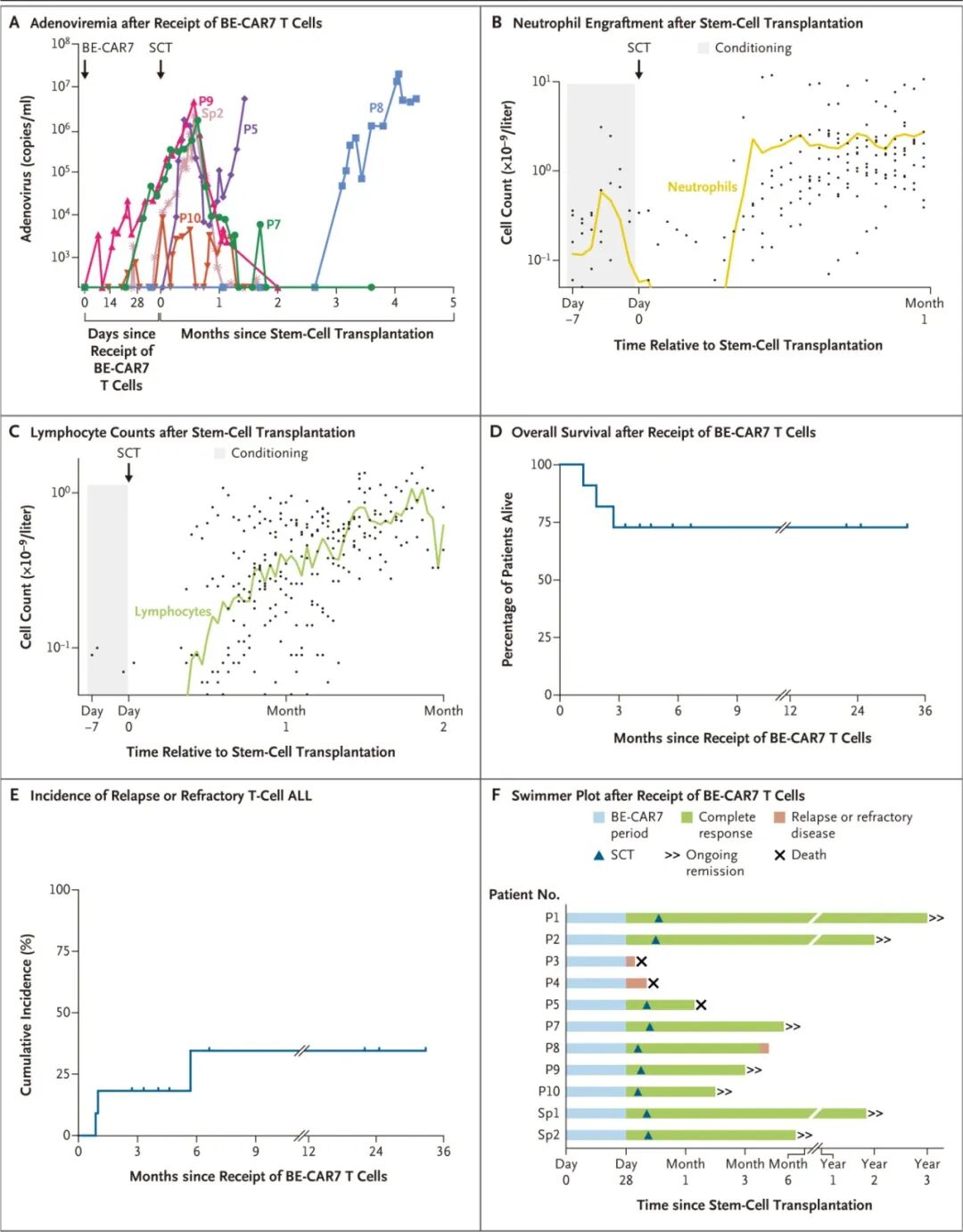
所有移植患者均清除了残留的BE-CAR7 T细胞,并实现了供者来源的造血重建。
截至数据分析,7名患者(64%) 在移植后3至36个月内持续缓解。
观察到2名患者出现CD7表达缺失的复发,即CD7抗原逃逸。
安全性结果:
常见不良事件:1-4级细胞因子释放综合征(82%,1例4级)、短暂性
病毒感染/再激活:所有患者均出现病毒血症(腺病毒、EB病毒、巨细胞病毒等),是主要的并发症来源,3例导致严重的移植后问题,1例因移植相关并发症死亡。
血液学毒性:所有患者均出现清淋和BE-CAR7治疗相关的多系血细胞减少。
无移植物抗宿主病:由于TCRαβ被敲除,未观察到GVHD。
死亡事件:研究期间有死亡病例,部分与感染相关。
本研究首次系统验证了碱基编辑+通用型CAR-T+移植桥接策略在T-ALL中的可行性和疗效。
通用型BE-CAR7 T细胞能够在复发/难治性T-ALL患者中诱导白血病缓解,使大多数患者能够成功进行异基因造血干细胞移植,展现出有前景的疗效。
作为一种“现货型”疗法,使用单一健康供者来源的细胞,为所有患者提供了快速可及的治疗选择。
CD7抗原丢失是导致复发的潜在机制之一,需进一步优化治疗策略。
病毒再激活和免疫抑制相关并发症是主要挑战,需加强监测和支持治疗。
参考文献
N Engl J Med . 2023 Sep 7;389(10):899-910. doi: 10.1056/NEJMoa2300709.
声明:本平台旨在为医疗卫生专业人士传递更多医学信息。本平台发布的内容,不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议。如该等信息被用于了解医学信息以外的目的,本平台不承担相关责任。本平台对发布的内容,并不代表同意其描述和观点。若涉及版权问题,烦请权利人与我们联系,我们将尽快处理。
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)