
近日,上海交通大学医学院附属瑞金医院

研究背景
免疫治疗通过激活免疫系统清除肿瘤,为控制远处转移带来新希望。针对PD-1/PD-L1的免疫治疗在晚期ESCC中已显示显著临床疗效(如 KEYNOTE-590、ESCORT-1st试验),新辅助免疫治疗领域的3期ESCORT-NEO/NCCES01试验也证实,
研究设计
PALACE-2是一项多中心、前瞻性、单臂I/II期临床试验(NCT03792347/NCT04435197),旨在评估PPCT在局部晚期ESCC中的有效性和安全性。研究纳入经组织学证实的局部晚期可切除ESCC患者。局部晚期ESCC定义为临床分期从cT2到cT4a不等,伴或不伴淋巴结转移,且无远处转移。患者接受PPCT方案新辅助治疗(帕博利珠单抗联合
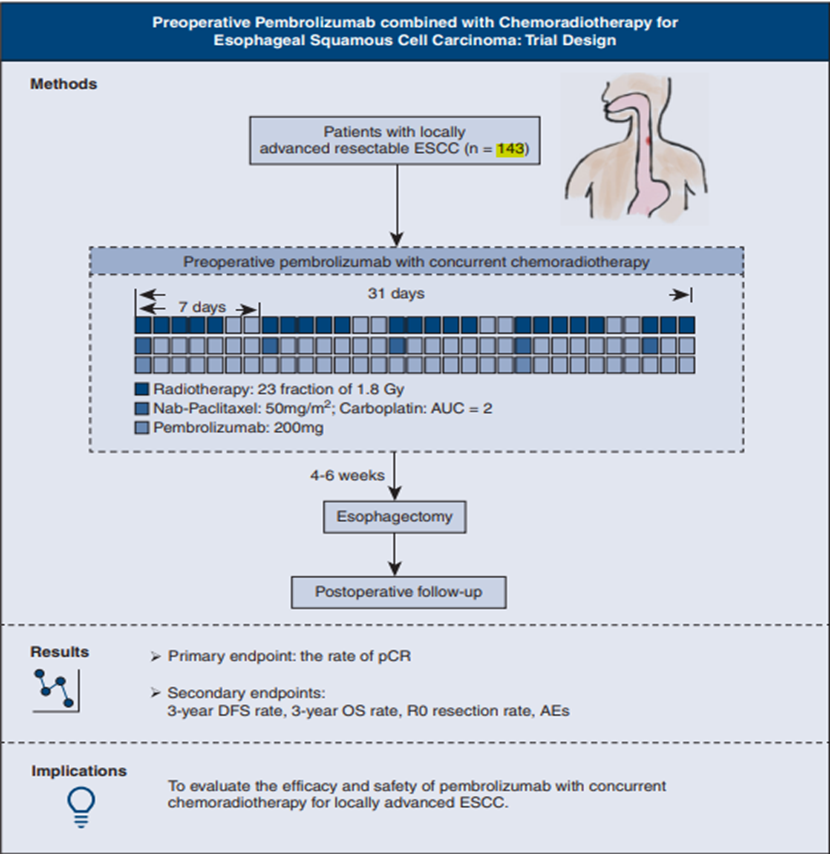
研究设计
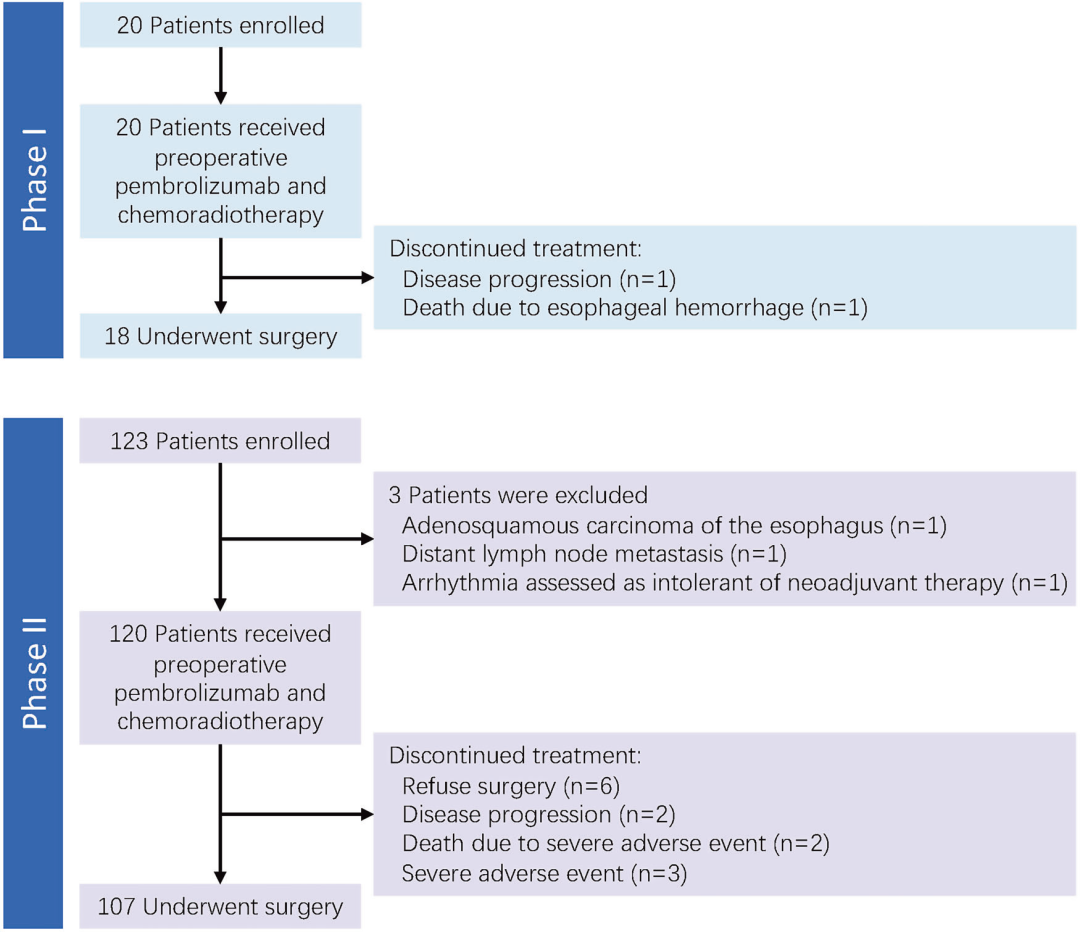
Flowchart
研究结果
2019年1月-2023年9月,共143例患者入组。其中3例患者在基线评估后被排除。因此,共140例患者接受新辅助治疗(安全性分析集);在这140例患者中,125例接受根治性食管癌切除术(疗效分析集)。
主要疗效结果
125例接受手术患者中,R0切除率达96.8%(121/125)。术后病理评估显示:
pCR率为43.2%(54/125,95%CI: 34.5%-51.9%);
48.0%(60/125)患者达到原发肿瘤完全缓解(肿瘤退缩分级TRG 1),27.2%(34/125)为TRG 2,主要病理缓解(mPR,定义为原发灶残存活肿瘤细胞≤10%)率达78.4%(98/125);
术后病理分期以ypTNM I期为主(73.6%),II期5.6%,IIIA期14.4%,IIIB期4.8%。
中位随访时间17.4个月(范围:0.7-66.3个月),患者1年DFS率为91.1%,1年OS率达96.5%;2年DFS率71.4%,2年OS率86.7%。
22例患者出现复发/转移,中位复发时间12.6个月,1年复发率40.9%,2年复发率95.5%,其中局部区域复发占45.5%,远处或混合复发占54.5%。
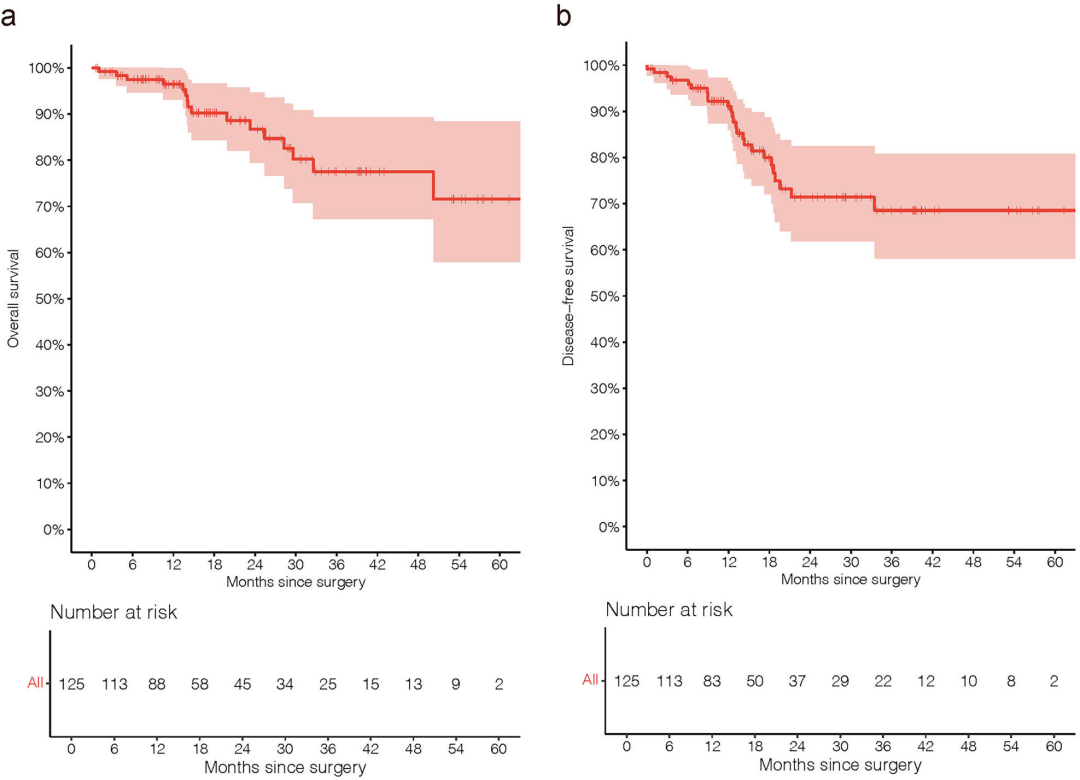
Kaplan-Meier生存曲线(A:OS;B:DFS)
安全性分析
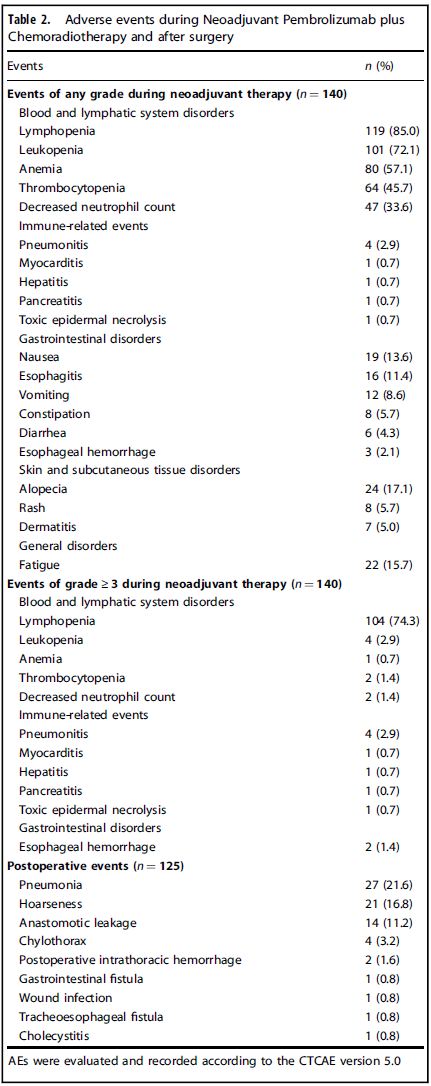
新辅助治疗期间,99.3%(139/140)患者出现治疗相不良事件(AE),75.7%(106/140)出现≥3级AE,主要为淋巴细胞减少(74.3%,104/140),且通常无需额外干预。其他≥3级AE包括白细胞减少(2.9%)、
手术相关并发症方面,术后肺炎发生率21.6%(27/125),声音嘶哑 16.8%(21/125),吻合口漏11.2%(14/125),90天内术后死亡1例(因严重食管气管瘘)。
不良事件
TME重塑:免疫联合治疗驱动肿瘤反应性T细胞扩增
研究者通过对28例样本(包括11例PPCT后、9例nCRT后及8例初治肿瘤)的169183个细胞进行分析,鉴定出12个TME细胞簇(包括上皮细胞、基质细胞及7类免疫细胞)。结果显示:
nCRT和PPCT组均出现上皮细胞显著减少、基质细胞(成纤维细胞、内皮细胞等)比例升高,证实两种新辅助治疗均能有效靶向清除肿瘤细胞;
免疫细胞亚群中,nCRT/PPCT均能减少中性粒细胞浸润(尤其是具有免疫抑制功能的ISG15⁺中性粒细胞和促血管生成的VEGFA⁺中性粒细胞),同时显著增加T细胞浸润,其中CD8⁺ T细胞是主要扩增亚群;
与nCRT相比,PPCT可进一步扩增肿瘤反应性CXCL13⁺CD8⁺ T细胞和CXCL13⁺CD4⁺ T细胞(此类细胞具有高肿瘤反应性评分),提示抗PD-1联合放化疗可增强肿瘤特异性T细胞应答。
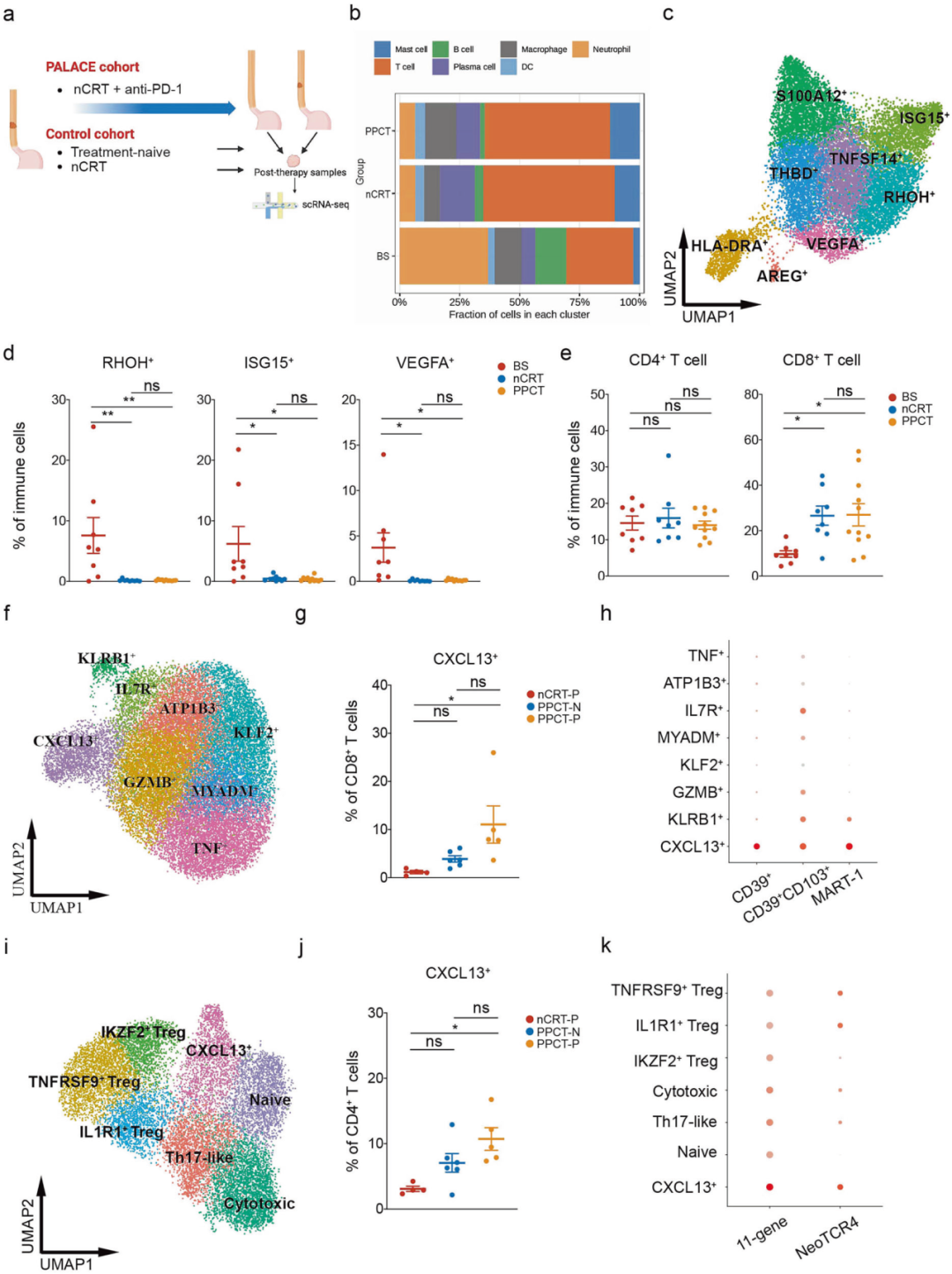
术前帕博利珠单抗联合放化疗调节TME
机制突破:IL-6水平预测治疗响应,中和IL-6增强疗效
通过对比PPCT有效组(pCR)与无效组(非pCR)的T细胞功能及血清细胞因子水平,研究者发现:
PPCT有效组中,细胞毒性CD4⁺ T细胞(高表达GZMA、PRF1、IFNγ)比例显著升高,而具有强免疫抑制功能的TNFRSF9⁺调节性T细胞(Treg)比例显著降低;
血清细胞因子分析显示,基线IL-6水平是唯一与PPCT响应相关的因子,有效组基线IL-6水平显著低于无效组,且无效组治疗后IL-6水平升高,提示基线高IL-6可能预测不良响应;
体外实验证实,IL-6处理可降低CD4⁺ T细胞的细胞毒性效应分子表达;小鼠皮下肿瘤模型中,抗IL-6联合抗PD-1治疗的肿瘤退缩效果显著优于单药治疗,且肿瘤浸润细胞毒性CD4⁺ T细胞比例最高,证实IL-6中和可通过增强CD4⁺ T细胞毒性提升免疫治疗疗效。
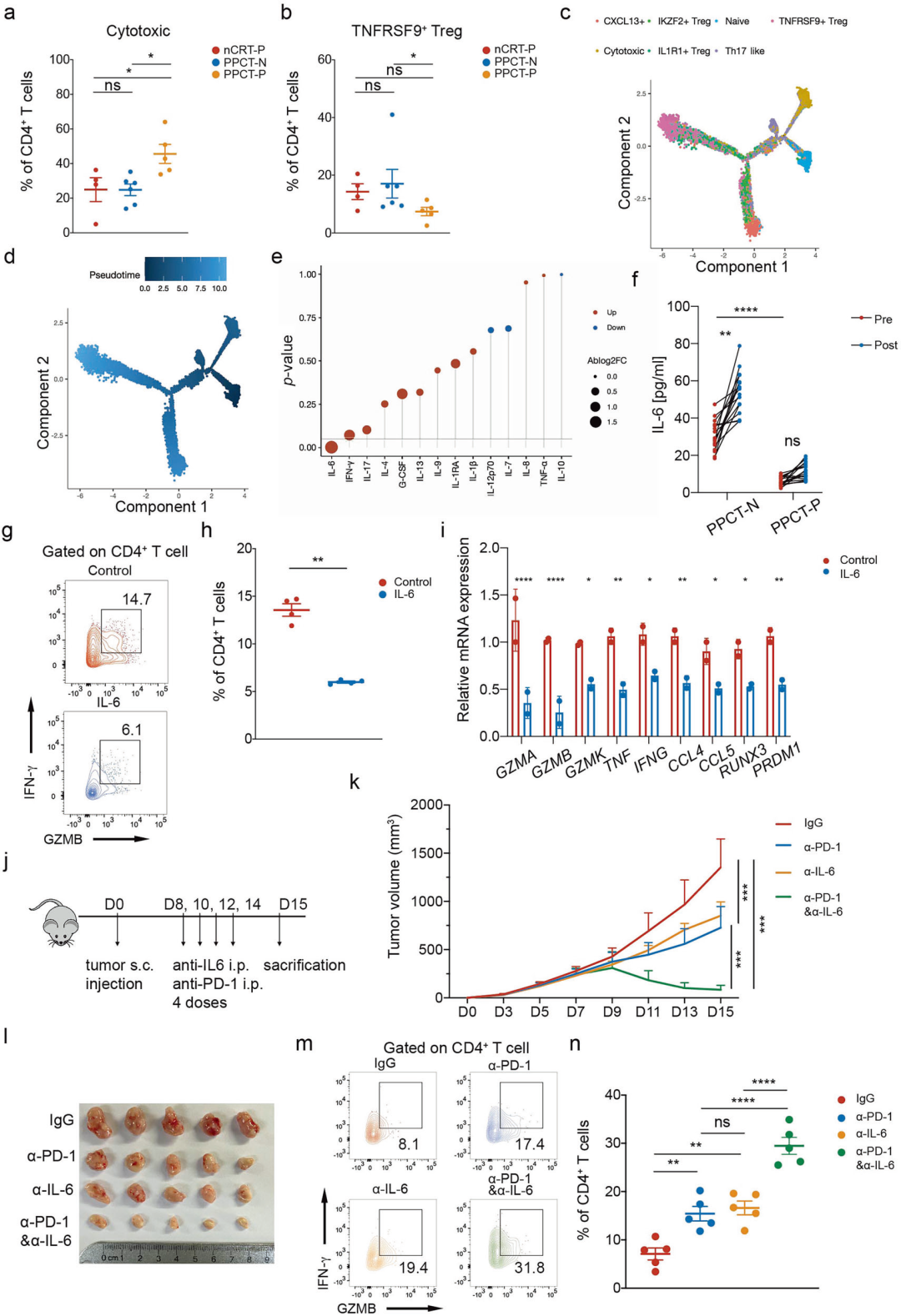
在抗PD-1阻断治疗下,病理缓解与增强的CD4⁺ T细胞细胞毒性编程及降低的血清IL-6水平相关
研究结论
综上所述,PALACE-2研究成功完成了首项评估帕博利珠单抗联合放化疗新辅助治疗局部晚期可切除食管鳞癌的大规模前瞻性I/II期临床试验。研究证实该联合方案安全可行,病理缓解率和短期生存率与标准新辅助放化疗相当。通过深入的转化研究,首次在单细胞层面系统阐明了该方案重塑肿瘤免疫微环境、扩增肿瘤反应性T细胞的作用机制,并创新性地发现基线血清IL-6水平与疗效相关,临床前实验证明IL-6阻断可增强抗PD-1治疗疗效。这些成果不仅为局部晚期食管鳞癌的新辅助治疗提供了新的可选策略,更通过揭示IL-6的关键作用,为未来筛选优势人群、开发增效联合方案以及克服免疫治疗耐药指明了富有潜力的科学方向。最终,该方案能否转化为长期生存获益,仍有待PALACE-3等III期随机对照研究的最终验证。
推荐阅读
来源:肿瘤界
执行:Aurora

(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)