目前,对于常规疗法应答率低的AS及PsA患者,肿瘤坏死因子抑制剂(TNFi)和Janus激酶抑制剂(JAKi)均被推荐作为对常规治疗反应不足患者的二线疗法。TNFi在预防葡萄膜炎方面的疗效已获证实,但既往关于JAKi的证据主要源于小样本研究,缺乏稳定的对照组,且JAKi对比TNFi在降低葡萄膜炎风险方面的相对有效性数据仍然有限。本研究通过大规模真实世界数据,旨在比较JAKi与TNFi治疗对AS及PsO疾病患者合并葡萄膜炎风险的影响。
研究设计
本研究为一项回顾性队列研究,数据源于TriNetX美国协作网络(涵盖约 1.16 亿患者)的电子健康记录。参与者纳入标准为2000-2023年间至少有两次AS、PsO或PsA诊断的成年患者(≥18岁),经1:1倾向评分匹配(PSM)平衡基线特征后,使用Cox比例风险模型估算新发葡萄膜炎的风险比(HR),并以TNFi作为参考。诊断依据《国际疾病分类第十版临床修订版》(ICD-10-CM)编码进行确定。研究采用“目标试验模拟”设计。暴露定义为研究期间首次开具JAKi或TNFi处方并将该日期定为索引日期。
排除标准
2026年1月1日前,具有JAKi或TNFi的任何先前处方记录的患者。
JAKi队列:包括接受任何JAK抑制剂(通过解剖治疗化学:ATC代码L04AA识别)新处方的患者。
TNFi队列:包括任何TNFi治疗的患者,特别是TNF单克隆抗体(TNF mAb),由ATC代码L04AB识别。
2016年1月1日后使用过上述药物、研究期间同时或交替使用两类药物以及索引日期前已有葡萄膜炎病史的患者。
结局
本研究以新发葡萄膜炎为主要结局。葡萄膜炎的诊断亚型包括:脉络膜视网膜炎症(ICD-10-CM代码H30)、虹膜睫状体炎(H20)、全葡萄膜炎(H44.11)、交感性葡萄膜炎(H44.13)、眼结节(H16.24)以及视网膜
协变量
符合条件患者的基线特征均提取自TriNetX数据库。涵盖关键的人口统计学变量(年龄、性别、种族、民族、
统计分析
亚组分析:按年龄、性别和种族进行分层,以评估潜在的效应修饰作用;基于潜在疾病类型(AS 与PsO疾病)进行额外亚组分析;按参与者接受具体JAKi类型进行分层,探索治疗异质性。对治疗期间合并使用csDMARDs的影响进行评估,以确定其与JAKi或TNFi疗法对葡萄膜炎风险的作用的相关性。按ESR和CRP水平进行分层分析,以评估基线炎症严重程度对治疗结局的影响。
敏感性分析:对一获FDA批准用于治疗葡萄膜炎的生物制剂进行了一项敏感性分析,将其作为参考组进行专门比较。利用TriNetX数据进行额外分析,以进一步评估结果在不同数据集中的一致性。
基线特征
研究从TriNetX数据库中筛选出697,850例AS、PsO或PsA成年患者。经纳入与排除标准筛选后,共有53,915例在2016-2023年间新使用JAKi或TNFi的患者被纳入分析(图1)。经PSM匹配后,每组包含5,874名患者,基线特征平衡良好(标准化均数差<0.1)。其中JAKi组平均年龄53.5岁,女性占66.3%(表1)。
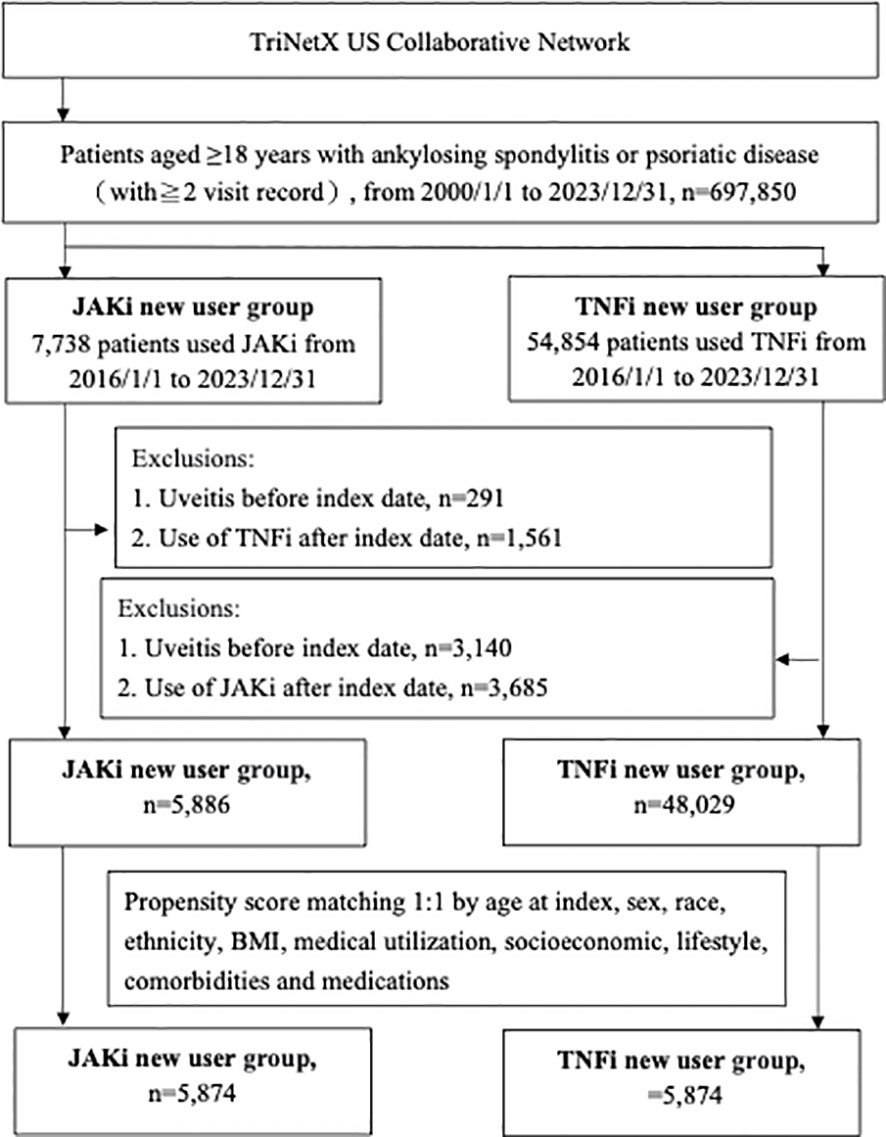
图1 研究队列选择的受试者选择流程图
主要结局
Cox回归分析显示,在所有模型中,JAKi组发生葡萄膜炎的风险始终显著低于TNFi组(表1)。主模型(Model 1)显示HR为0.630,即风险降低了约37%(表1)。Kaplan-Meier曲线亦显示JAKi组9年累积发病率显著更低(P=0.009)(图2)。
表1 自身免疫性疾病患者接受JAKi与TNFi治疗9年随访期间新发葡萄膜炎事件的风险
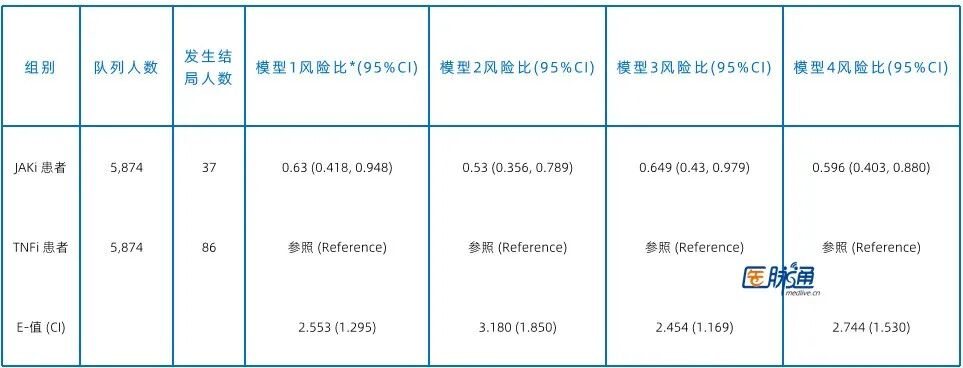
JAKi组相比于TNFi组发生结局的风险比(PSM后)
95% CI:95% 置信区间
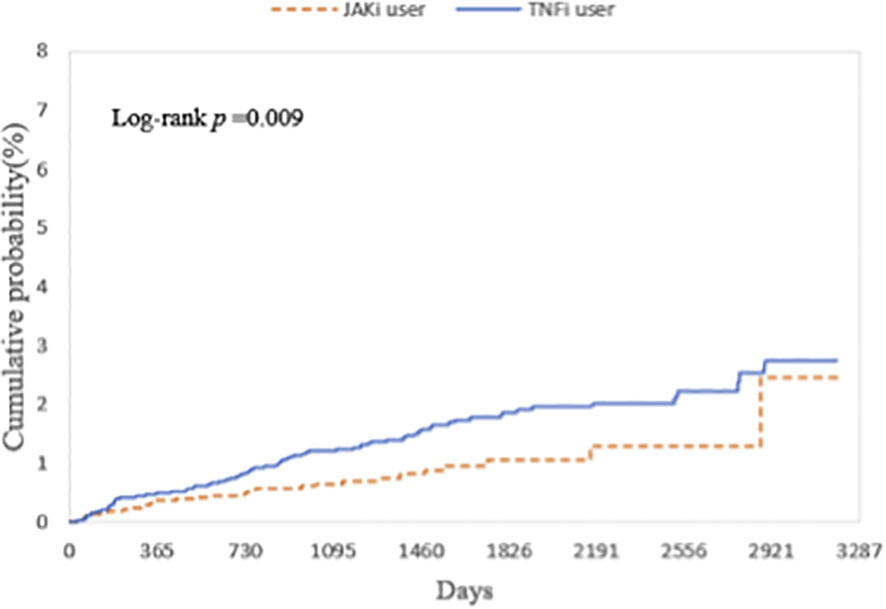
图2 Kaplan-Meier曲线显示了葡萄膜炎的累积概率(%),比较了在9年随访期内用JAKi与TNFi治疗的自身免疫性疾病患者中发生葡萄膜炎事件的风险
亚组分析
高危人群获益:在老年患者(≥51岁,HR 0.43)和白人个体(HR 0.59)中,JAKi的保护作用更为显著(图S1)。
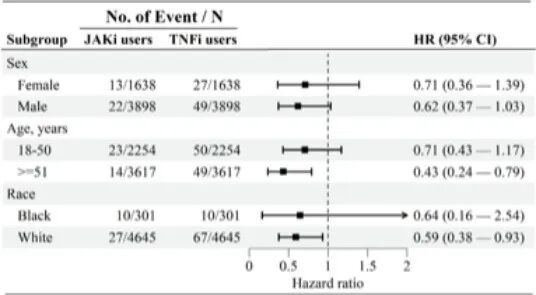
图S1 随访期间,与TNFi相比,JAKi治疗后根据年龄、性别和种族对葡萄膜炎风险进行分层

图S2 随访期间,与TNFi相比,JAKi治疗后葡萄膜炎风险的疾病分层
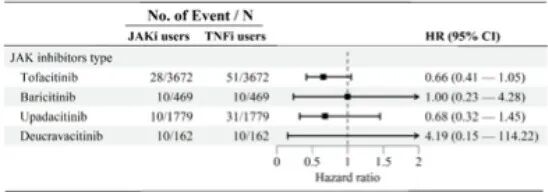
图S3 随访期间,JAKi与TNFi治疗后葡萄膜炎发病风险的JAKi具体类型分层分析
合并用药:无论是/否合并使用csDMARDs(HR为0.50(95% CI,0.28-0.92)/0.56(95% CI,0.33-0.94)),JAKi均显示出一致的保护作用(图S4)。

图S4 随访期间,csDMARDs使用时,JAKi与TNFi治疗后葡萄膜炎发病风险的分层分析
炎症状态:在基线炎症指标升高的患者中(CRP ≥3 mg/L或ESR ≥20 mm/h),JAKi显著降低了风险(HR分别为0.50和0.41),而在低炎症水平患者中差异不显著(图S5)。
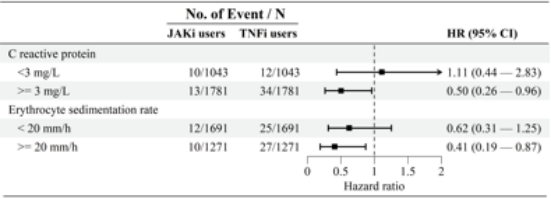
图S5 随访期间,按全身炎症水平分层后,JAKi与TNFi治疗后葡萄膜炎发病风险的对比分析
敏感性分析
多项敏感性分析如限制为至少两次处方(HR,0.605; 95%CI,0.385-0.952)、排除早期药物切换(HR,0.675; 95% CI,0.471-0.969)等结果均与主要分析一致,与TNFi相比,JAKi治疗与葡萄膜炎风险显著降低相关,证实了结果的稳定性。
在这项针对AS、PsO或PsA患者的大规模队列研究中,我们发现与TNFi疗法相比,启动JAKi疗法与较低的新发葡萄膜炎风险显著相关。这一发现在所有四项敏感性分析中均保持高度一致,有力地支持了主要结果的稳定性。亚组分析进一步表明,JAKi疗法对葡萄膜炎的保护作用在老年人、白人个体以及炎症标志物升高(CRP ≥3 mg/L 或 ESR ≥20 mm/h)的患者中更为显著。值得注意的是,这种关联无论患者是否合并使用 csDMARD 均保持不变。
早期研究表明,JAKi治疗可为难治性幼年特发性关节炎(JIA)合并相关葡萄膜炎及难治性非感染性葡萄膜炎或巩膜炎患者带来临床改善,并可能显著减少活动性非感染性葡萄膜炎的治疗失败风险。此外,研究发现,TNFi、JAKi和IL-17抑制剂均降低了前葡萄膜炎的风险,且彼此间无显著差异,但其排名分析倾向于TNFi风险最低。这些既往研究结果的差异,凸显了本研究清晰地描绘JAKi与既定生物疗法在预防葡萄膜炎方面的相对有效性的重要意义。
在临床实践中,TNFi通常被用作AS和PsA的一线生物制剂,特别是对于有中轴受累或葡萄膜炎既往史的患者。相比之下,JAKi 更常被二线用于疾病更严重或对常规疗法(包括 TNFi)反应不佳的患者。为减少这种潜在偏倚,本研究将队列限制在既往无葡萄膜炎诊断的“新用户”患者,并利用PSM调整了疾病严重程度的替代指标(包括基线 CRP、ESR 以及治疗启动前一年内 csDMARDs 的既往暴露情况)。
研究在接受JAKi的患者中观察到的较低葡萄膜炎风险,可能与其机制有关。JAKi通过抑制关键细胞因子(包括 IL-6、IL-12 和 IL-23)来调节多种炎症通路,可从源头上调控IL-23与Th17介导的免疫反应,JAKi实现的更广泛细胞因子抑制可能有助于降低葡萄膜炎风险。JAKi对于疾病严重或对常规疗法反应不佳的患者提供了潜在的更优选择。本研究填补了 JAKi 与 TNFi 在眼部并发症风险对比方面的证据空白。


本项真实世界队列研究证实,JAK抑制剂疗法对AS及PsO疾病患者的保护作用显著,与 TNFi 治疗相比,可明显降低该人群新发葡萄膜炎的风险,这进一步佐证了 JAKi 在改善患者眼部炎症预后方面的潜在应用价值。
参考文献:
Bai WH, Liao PL, Bai YC, Wei JC. Comparative risk of uveitis with Janus kinase inhibitors versus tumor necrosis factor inhibitors in ankylosing spondylitis and psoriatic diseases: a target trial emulation study. Front Immunol. 2025 Oct 24;16:1673970. doi: 10.3389/fimmu.2025.1673970. PMID: 41208989; PMCID: PMC12592076.
医脉通是专业的在线医生平台,“感知世界医学脉搏,助力中国临床决策”是平台的使命。医脉通旗下拥有「临床指南」「用药参考」「医学文献王」「医知源」「e研通」「e脉播」等系列产品,全面满足医学工作者临床决策、获取新知及提升科研效率等方面的需求。

(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)