研究背景
长久以来,
2025年发表于《Annual Review of Pathology》的综述《Roles of Cellular Neighborhoods in Hepatocellular Carcinoma Pathogenesis》[1](以下简称“该综述”)系统梳理了这一新兴领域的关键进展,提出“细胞邻域”(CNs)不仅是HCC微环境的基本结构单元,更是决定疾病走向的核心调控者。本文将结合该综述内容,深入解读HCC中细胞邻域构建的机制、功能异质性及其临床转化潜力,为读者提供理解HCC微环境的新视角。
什么是“细胞邻域”?——微环境的空间组织逻辑
“细胞邻域”概念源于对肿瘤组织空间结构的高维解析。传统病理切片仅能呈现二维形态,而现代空间组学技术(如Visium、CODEX、MIBI等)则能在保留组织原位信息的前提下,同时检测数十种细胞类型及其相互关系。由此发现,肿瘤并非随机混杂的细胞集合,而是由若干具有特定细胞组成、空间排布和功能特征的“邻域单元”构成。
在HCC中,这些邻域单元通常包含以下几类核心成员:
恶性肝细胞:驱动肿瘤生长的主体;
肿瘤相关巨噬细胞(TAMs):尤其是表达SPP1(骨桥蛋白)或TREM2(髓系细胞触发受体2)的亚群,在纤维化和免疫抑制中起关键作用;
活化的肝星状细胞(aHSCs)与癌相关成纤维细胞(CAFs):分泌细胞外基质(ECM),形成物理屏障并释放促炎因子;
调节性T细胞(Tregs)与耗竭性T细胞(Tex):介导局部免疫抑制;
肝窦内皮细胞(LSECs)与血管内皮细胞:参与血管生成与免疫细胞招募。
这些细胞并非均匀分布,而是以特定组合聚集形成“热点区域”,如肿瘤边缘区、坏死周边区、纤维间隔区等。不同区域的邻域结构差异巨大,其生物学行为亦迥然不同。
HCC邻域生态的三大典型模式
该综述基于多项单细胞与空间组学研究[2-4],归纳出HCC中三种具有代表性的细胞邻域模型:
免疫排斥型邻域常见于肿瘤边界区域,SPP1⁺巨噬细胞与癌相关成纤维细胞(CAFs)通过分泌细胞外基质(如胶原)形成物理屏障,阻止T细胞浸润至肿瘤内部。其核心驱动者是活化的CAFs和SPP1⁺ TAMs。SPP1不仅促进ECM沉积,还能通过CD44和整联蛋白信号通路激活TGF-β通路,进一步强化纤维化与免疫抑制。
值得注意的是,Liu等[5]的泛癌分析指出,SPP1高表达与HCC门静脉侵犯及微血管浸润显著相关,而在HCC中其表达水平与门静脉侵犯、微血管浸润显著正相关。这提示SPP1不仅是生物标志物,更可能是治疗干预的潜在靶点。
多见于肿瘤侵袭边缘,此处虽有T细胞浸润,但功能严重受损。Ruf等人[3]发现,肿瘤边缘的CSF1R⁺PD-L1⁺肿瘤相关巨噬细胞(TAMs)可通过PD-L1/CSF1R信号轴诱导黏膜相关不变T细胞(MAIT cells)功能失调,表现为IFN-γ和颗粒酶B分泌减少。MAIT细胞本应具备抗肿瘤活性,但在HCC微环境中却表现出IFN-γ分泌减少、颗粒酶B表达下降,甚至转为促炎表型。此外,Tregs在此区域高度富集,通过CTLA-4、IL-10和TGF-β等机制抑制效应T细胞活性。
此类邻域见于慢性肝病(如MASH、HBV/HCV感染)的癌前阶段,是HCC发生的“土壤”,而非HCC肿瘤内的成熟邻域结构。多见于慢性肝病背景下的非肿瘤肝组织,尤其在非酒精性脂肪性肝炎(NASH)或
该邻域位于肿瘤外,属于癌前肝脏组织,尚未形成典型肿瘤CNs。这类邻域虽未形成明确肿瘤,但已具备“癌前微环境”特征:持续的炎症刺激、肝细胞代偿性增殖、DNA损伤累积,为肝癌恶性转化埋下伏笔。
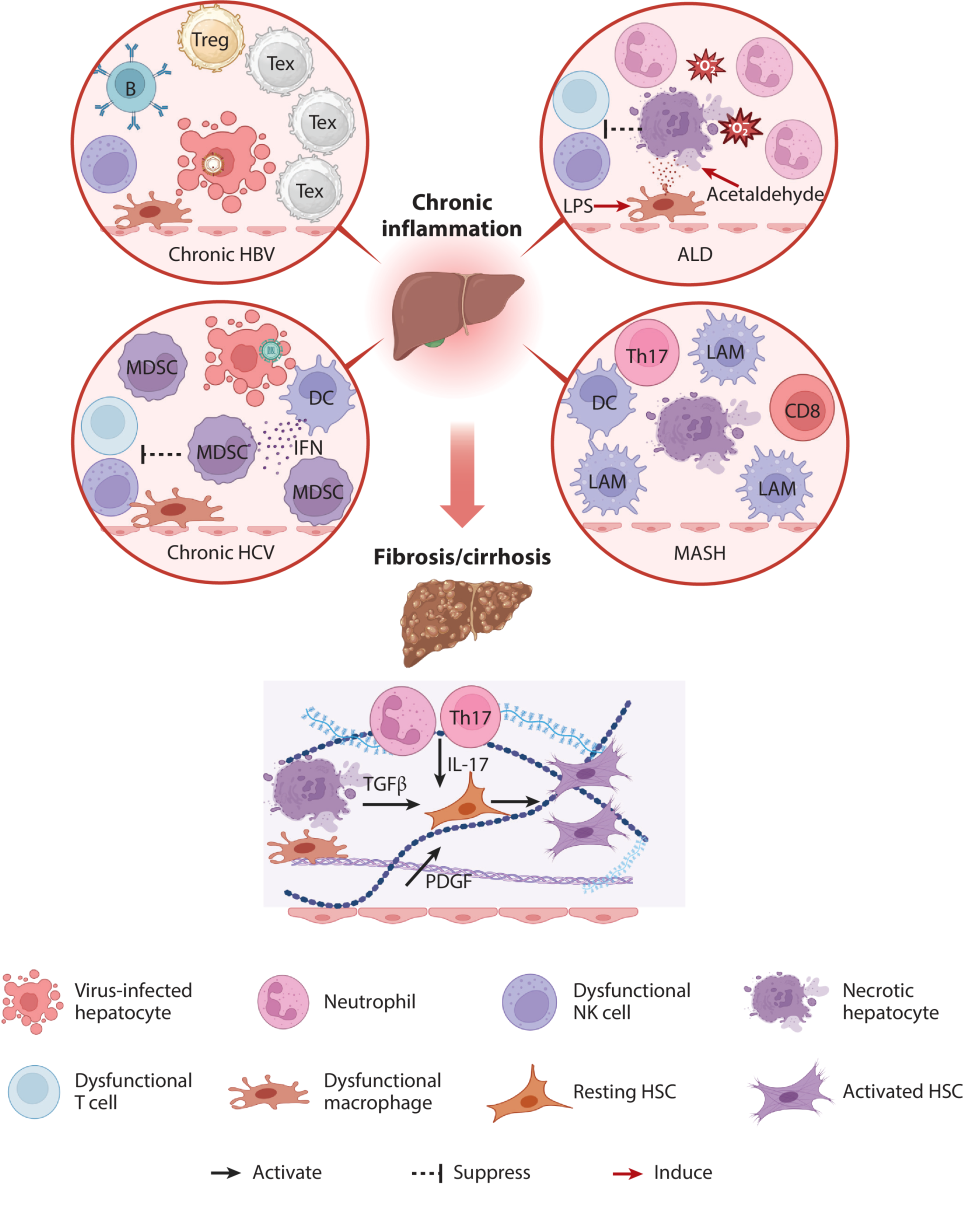
图1. 不同病因(HBV/HCV/ALD/MASH)下的代表性CNs
(该图引自Annual Review of Pathology综述原文,原图改编自BioRender.com)
细胞邻域间的相互作用如何推动HCC进展?
细胞邻域并非静态结构,而是动态演化的功能网络。其互作机制主要包括:
例如,恶性肝细胞表面的Galectin-9可与T细胞上的TIM-3结合,诱导T细胞凋亡;CAFs可通过分泌细胞外基质(如POSTN)与巨噬细胞互作形成物理屏障。
TAMs分泌IL-6、TNF-α激活STAT3/NF-κB通路,促进肿瘤细胞存活;CAFs释放HGF激活c-MET通路,增强肿瘤侵袭性;内皮细胞分泌VEGF不仅促进血管生成,还可直接作用于肿瘤细胞[8]。
致密胶原网络增加组织刚度,通过YAP/TAZ通路激活肿瘤干细胞特性;同时阻碍药物渗透与免疫细胞迁移。这些相互作用共同构建了一个正反馈式的恶性循环:炎症→纤维化→免疫抑制→肿瘤生长→更多炎症。
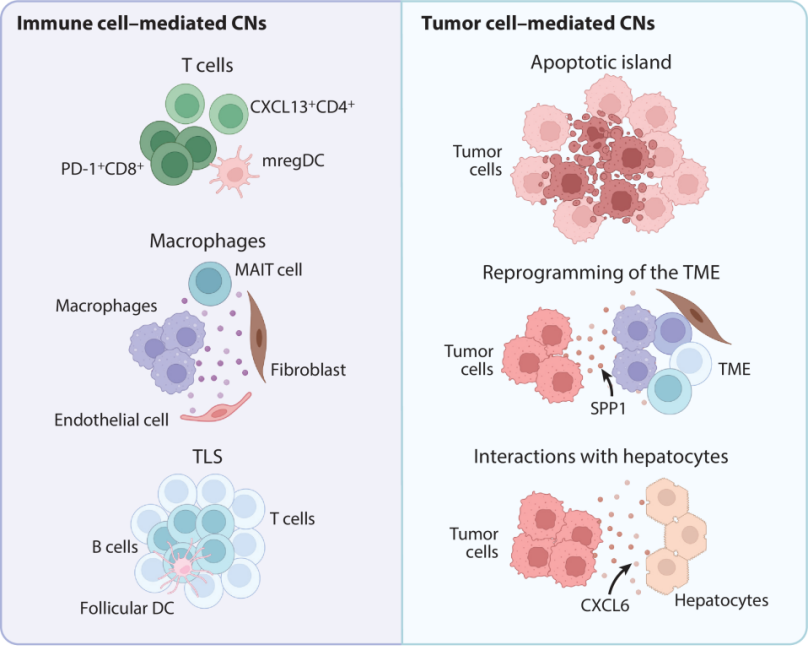
图2. HCC 肿瘤内免疫-肿瘤-间质互作的典型CNs
(该图引自Annual Review of Pathology综述原文,原图改编自BioRender.com)
临床启示:从邻域视角重新思考HCC治疗策略
当前HCC一线治疗已进入“免疫联合抗血管”时代。然而,客观缓解率仍不足30%,耐药问题突出。该综述强调,理解细胞邻域有助于优化治疗选择与开发新策略:
未来或可根据肿瘤组织的邻域图谱进行分型(基于队列研究的探索性分型,尚需前瞻性研究验证):
免疫排斥型:可考虑联合靶向纤维化的策略(如TGF-β通路抑制剂,基于纤维化机制的潜在干预方向);
免疫抑制型:考虑双免疫检查点阻断(如PD-1 + CTLA-4)或靶向TAMs(如CSF1R抑制剂);
炎症-再生型:在癌前阶段干预代谢炎症(如FXR激动剂、CCR2/5拮抗剂)。
SPP1、TREM2、FAP等邻域特异性分子已成为热门靶点。例如,阻断SPP1可增强抗PD-1疗效,并伴随T细胞浸润增加。
传统RECIST标准难以反映微环境变化。未来或可通过液体活检(如循环TAMs、ECM降解产物)或影像组学间接评估邻域重构,实现早期疗效预测。
挑战与展望
尽管细胞邻域理论前景广阔,但仍面临诸多挑战:
空间组学成本高昂,难以普及至常规临床;
邻域定义尚未标准化,不同平台数据整合困难;
动态演化过程缺乏纵向研究支持。
单细胞与空间技术已被用于研究CNs。单细胞路线主要推断两类细胞或两个单细胞之间的配体-受体互作,空间路线可解析成对或成群的细胞邻域。若聚焦“双细胞”邻域,可借助空间邻近模型或配体-受体互作分析;若要鉴定“多细胞”邻域,则需采用空间邻近建模、概率模型或深度学习等计算方法。
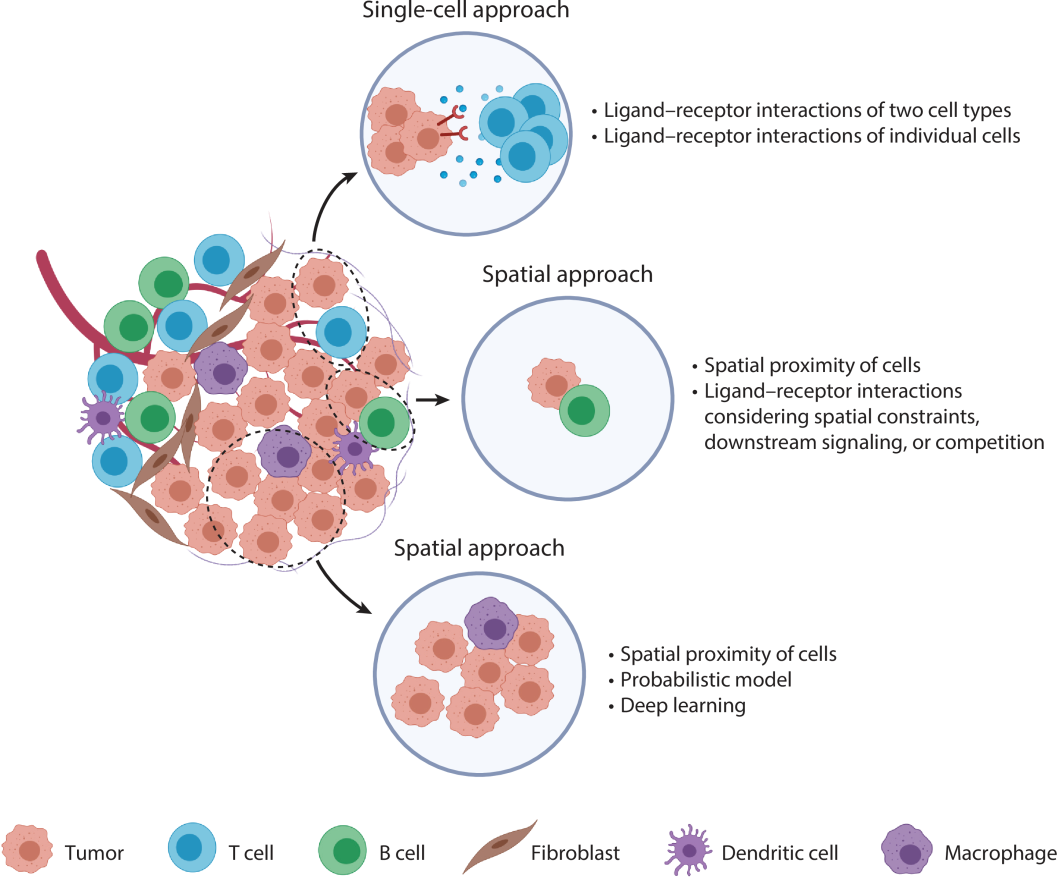
图3. 单细胞与空间技术已被用于研究CNs
(该图引自Annual Review of Pathology综述原文,原图改编自BioRender.com)
未来需推动多中心合作,建立HCC邻域图谱数据库,并开展基于邻域分型的前瞻性临床试验。
研究结论
肝细胞癌的发生发展并非仅由恶性肝细胞单独驱动,而是一场由多种细胞共同导演的“邻域共谋”。从“细胞邻域”视角出发,我们不仅能更深刻理解HCC的发病机制,更能为突破当前治疗瓶颈提供全新思路。对于临床医生而言,关注肿瘤微环境的空间组织逻辑,或将为HCC精准诊疗提供新思路。
参考文献:
[1] Ma L , Li C C , Wang X W. Roles of Cellular Neighborhoods in Hepatocellular Carcinoma Pathogenesis[J]. Annual Review of Pathology: Mechanisms of Disease, 2025, 20(1):169–192.
[2] Zhang M, Yang H, Wan LF, Wang ZH, Wang HY, et al. Single-cell transcriptomic architecture and intercellular crosstalk of human intrahepatic cholangiocarcinoma[J]. J. Hepatol, 2020, 73:1118–30.
[3] Ruf B, Bruhns M, Babaei S, Kedei N, Ma L, et al. Tumor-associated macrophages trigger MAIT cell dysfunction at the HCC invasive margin[J]. Cell. 2023, 186:3686–705.e32.
[4] Ramachandran P, Dobie R, Wilson-Kanamori JR, Dora EF, Henderson BEP, et al. Resolving the fibrotic niche of human liver cirrhosis at single-cell level[J]. Nature, 2019, 575:512–18.
[5] Liu Y, Ye G, Dong B, Huang L, Zhang C, et al. A pan-cancer analysis of the oncogenic role of secreted phosphoprotein 1 (SPP1) in human cancers[J]. Ann. Transl. Med, 2022, 10:279.
[6] Seidman JS, Troutman TD, Sakai M, Gola A, Spann NJ, et al. Niche-specific reprogramming of epigenetic landscapes drives myeloid cell diversity in nonalcoholic steatohepatitis[J]. Immunity, 2020, 52:1057–74.e7.
[7] Remmerie A,Martens L, Thone T, Castoldi A, Seurinck R, et al. Osteopontin expression identifies a subset of recruited macrophages distinct from Kupffer cells in the fatty liver[J]. Immunity, 2020, 53:641–57.e14.
[8] Goel HL, Mercurio AM. VEGF targets the tumour cell[J]. Nat. Rev. Cancer, 2013, 13:871–82.
审批编号:CN-171821
有效期至:2026-11-18
本材料由阿斯利康提供,仅供医疗卫生专业人士参考。
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)