
2025年7月21日,国际著名期刊《Advanced Science》(影响因子14.1)在线刊发了天津医科大学总医院神经内科张超课题组的研究论文“Type I interferon signaling augments autoimmunity in neuromyelitis optica spectrum disorder”。本研究深度解析了

NMOSD是一种由抗水通道蛋白-4(AQP4)抗体介导的中枢神经系统(CNS)自身免疫性疾病,主要累及视神经和脊髓,以反复发作的视神经炎和长节段脊髓炎为特征,导致患者发生严重而不可逆的神经功能残疾。虽然目前已有三种靶向药物(包括补体抑制剂
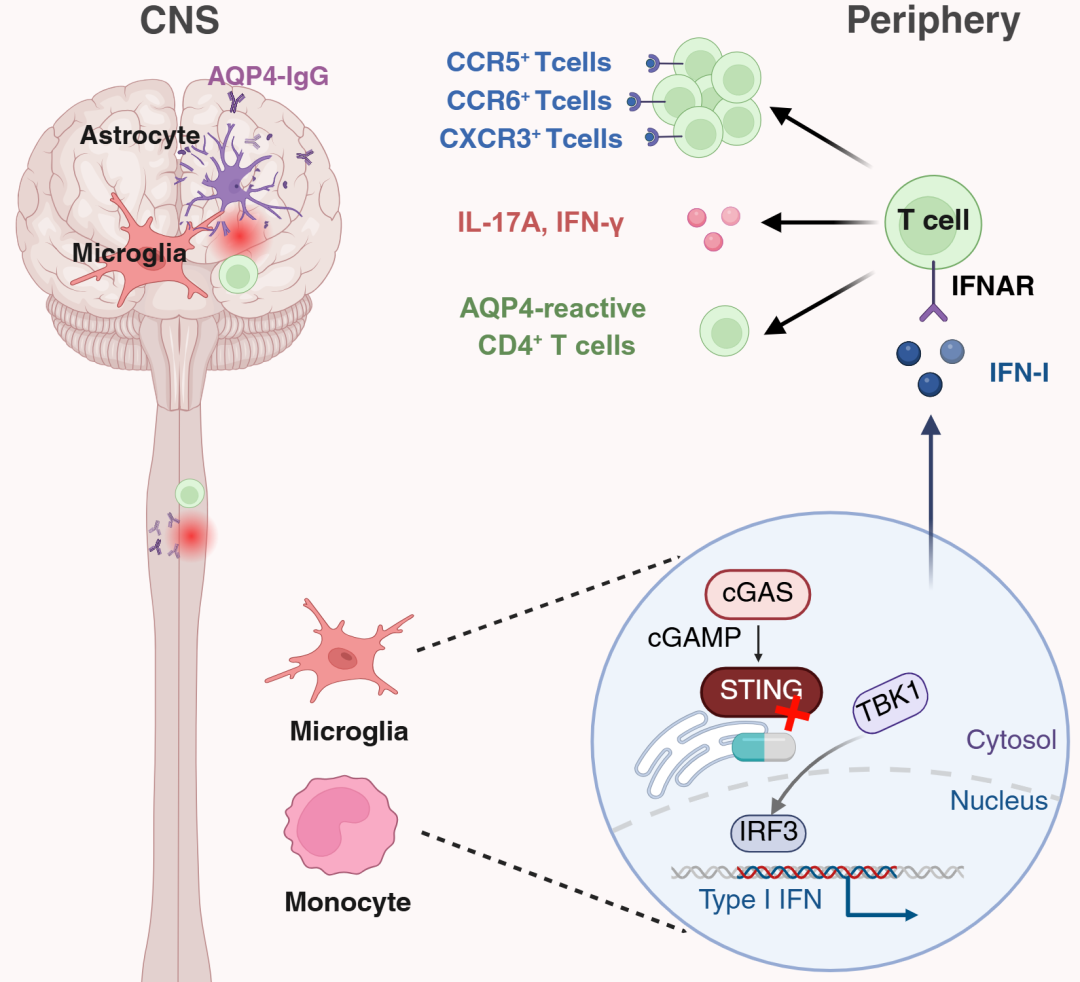
图.调控神经脊髓炎谱系疾病(NMOSD)I型干扰素信号传导的免疫学机制。NMOSD患者血浆和脑脊液cfDNA与cGAMP水平异常升高,激活外周单核细胞及CNS内小胶质细胞cGAS-STING-IFN-I信号通路。同时,在动物模型中CNS内小胶质细胞存在显著的线粒体损伤及DNA异常积累,伴随关键蛋白IRF3,TBK1的表达增强。异常产生的IFN-I会进一步扩增AQP4特异性自身反应性T细胞,并促使其分泌IL-17A、IFN-γ等促炎因子和增强其迁移浸润能力。上述因素共同驱动NMOSD中枢内病理损害。(来自Advanced Science. 2025 Jul 21. doi: 10.1002/advs.202500942)
张超课题组通过对NMOSD患者外周血和脑脊液中淋巴细胞的单细胞测序发现NMOSD患者的外周单核细胞及CNS内小胶质细胞/巨噬细胞cGAS-STING-IFN-I信号通路基因显著激活。接下来,课题组使用NMO-IgG脑内注射模型和AQP4特异性T细胞过继转移两种模型来验证单核/小胶质细胞通过IFN-I 在NMOSD发病过程中的变化,并通过构建AQP4-MHC II-Tetramer直接研究IFN-I对AQP4特异性自身反应性T细胞的影响。最终,在Sting-/-敲除小鼠体内,研究者发现小鼠表现出CNS内病灶周围小胶质细胞和星形胶质细胞活化减弱,且CNS浸润的炎性细胞包括活化的AQP4特异性T细胞显著减少,伴随CNS内脱髓鞘病灶体积明显缩小和临床症状的显著改善。这些发现确立了IFN-I信号通路既可直接驱动中枢固有免疫炎症,又赋能自身反应性T细胞,放大其对AQP4的免疫攻击作用。基于此,本研究不仅揭示了IFN-I(包括IFN-β)通路在NMOSD发病中的重要作用,即异常激活的IFN-I信号并非起到保护作用,而是NMOSD的“主凶”而非“盟友”,产生与多发性硬化截然相反的作用。
近十年以来,张超课题组专注于NMOSD的临床和基础研究工作,探索了靶向浆细胞的治疗策略(JAMA Neurology 2017; IF:21.3);并率先在国际上完成了NMOSD生物制剂与传统口服免疫抑制剂的头对头对比性临床研究(Lancet Neurology 2020; IF:45.5),受邀在国际神经免疫会议ECTRIMS做大会报告,为靶向IL-6受体治疗NMOSD提供了I 级循证医学证据。目前,IL-6受体阻断疗法已被批准用于治疗NMOSD。同时, 张超等发现了靶向BCR信号通路相关激酶BTK治疗NMOSD的潜力(Neurology: Neuroimmunology and Neuroinflammation 2021; IF:7.5; Journal of Neuroinflammation 2023, 2025; IF:10.1),并参与NMOSD国际大型多中心临床实验的评估(Lancet Neurology 2024; IF:45.5)。目前,课题组正在开发I型干扰素通路的单克隆抗体作为NMOSD潜在新治疗的系列工作。本研究得到了国家自然科学基金、天津市杰出青年科学基金的资助,京津神经免疫中心的同仁也给予了大力支持。
张超
主任医师、研究员,博士生导师
天津医科大学总医院神经内科副主任
擅长各类神经免疫性疾病和神经内科疑难、危重病的诊治
目前担任中华神经病学分会肌电图与临床神经生理学组委员、天津市神经免疫学组组长等
作为第一执笔者撰写了《中国视神经脊髓炎谱系疾病诊断与治疗指南(2025)版》(中华神经科杂志2025年第07期)
审核:天津医科大学总医院 张超
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)