
细支气管为直径小于2毫米、壁内无软骨及黏液腺体的气道终末分支,按结构可分为膜性细支气管与呼吸性细支气管。细支气管炎(bronchiolitis)是指一组以细支气管为主要病变部位的异质性疾病,涉及多种病因、不同影像及组织病理特征,预后亦各异。本文依托最新研究成果,基于病因学角度系统归类细支气管炎类型,探讨其临床表现、诊断思路及治疗策略,旨在为临床实践提供循证指导。
细支气管是支气管树的终末分支,直径小于 2mm,管壁无软骨和黏液腺,分为膜性细支气管(8-14个分支)和呼吸性细支气管(终末细支气管衍生的 3 级分支)。膜性细支气管进入次级肺小叶后分为 3-5 个终末细支气管,后者进一步延伸为呼吸性细支气管,是气道传导与气体交换的重要结构。细支气管炎特指细支气管的炎症或纤维化病变,可导致气流受限等功能异常。
按病因将成人细支气管炎归为以下数类:
急性感染性细支气管炎在儿童中多见,但成人亦可发病,病原体涵盖病毒(如呼吸道合胞病毒、腺病毒、流感病毒等)、细菌(如肺炎支原体、肺炎链球菌等)、分枝杆菌、真菌及寄生虫等。部分患者在感染后遗留纤维化及细支气管闭塞,称为感染后性细支气管炎或感染后性闭塞性细支气管炎,多见于婴幼儿,但成人亦有散在报道。
Swyer-James-MacLeod综合征被认为是婴幼儿期闭塞性细支气管炎后遗症,CT可见肺透明度增加、支气管扩张及肺动脉发育不良等改变。
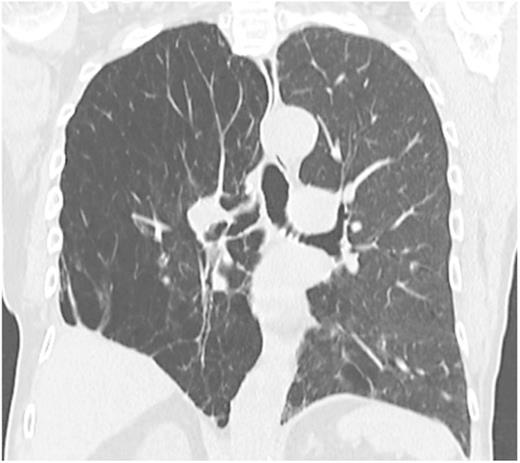
图 Swyer James MacLeod综合征:CT图像:受影响的肺由于肺泡过度扩张而呈高透明,血管分布减少。存在支气管扩张
烟雾、化学毒物、工业粉尘等吸入可致呼吸道上皮损伤,继而发展为限制性或闭塞性细支气管炎。其中,香烟烟雾引起的呼吸性细支气管炎(respiratory bronchiolitis)多见于吸烟者,表现为轻度炎性反应和间质纤维化,部分可进展为RB-ILD。
职业性暴露亦是重要致因,如爆米花工厂吸入二乙酰、粮仓吸入氮氧化物、战争相关毒气吸入等,均可导致职业性细支气管炎。
尽管少见,仍有若干药物可诱发细支气管损伤,包括青霉胺、氨达龙、EGFR-TKI(如阿法替尼)、美沙拉嗪、利妥昔单抗及免疫检查点抑制剂等。
慢性误吸与胃食管反流在移植人群中较常见,可诱发细支气管持续性炎症反应及纤维化,最终形成误吸性细支气管炎。
BOS为器官移植后慢性移植物排斥表现之一,临床以FEV₁持续下降为特征,是心肺或造血干细胞移植患者主要并发症之一。其发病与原发移植物损伤、急性排斥反应、气道感染、胃食管反流及自身免疫等密切相关。
滤泡性细支气管炎:由反复抗原刺激引发支气管周围淋巴滤泡增生,常与自身免疫病(如类风湿关节炎、干燥综合征)、病毒感染及免疫缺陷状态相关。
弥漫性泛细支气管炎(DPB):几乎仅见于亚洲中年男性,常合并慢性鼻窦炎,HLA-Bw54及A11基因型阳性率高,预后与铜绿假单胞菌感染密切相关。
间质性肺病相关:RB-ILD、脱屑性间质性肺炎、特发性肺纤维化等。
与其他肺部疾病相关:如哮喘、COPD、支扩、囊性纤维化、原发性纤毛运动障碍等。另外DIPNECH与类癌瘤样肿瘤,可导致支气管纤维化及腔道狭窄,影像上呈“马赛克”样低密度区域。
结缔组织病相关:类风湿关节炎相关细支气管炎最为常见,亦可见于系统性红斑狼疮、系统性硬化症及炎性肠病。
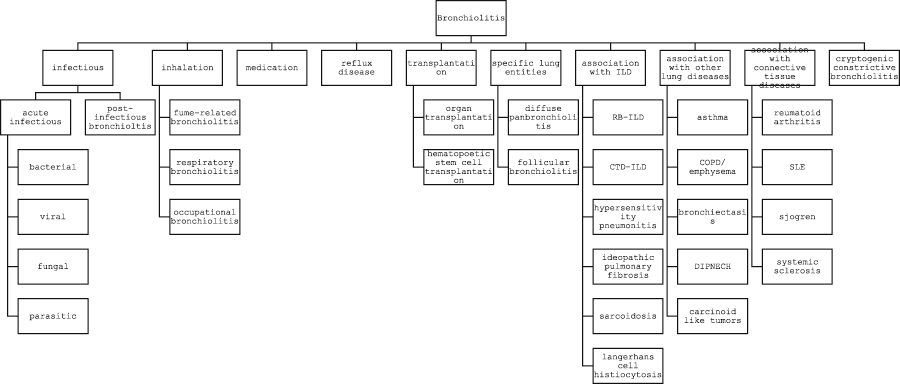
图 细支气管炎的病因分类
细支气管炎的临床表现因病因与炎症类型而异。急性型多起病迅速,表现为发热、干咳、喘息,肺部听诊可闻湿啰音或呼气相哮鸣。慢性或限制型细支气管炎如BOS、误吸性细支气管炎等则以渐进性呼吸困难、运动耐力下降为主,部分患者合并体重下降与乏力。
多呈现不可逆性气流受限,表现为FEV₁降低、RV及RV/TLC升高,提示气体滞留。弥散功能(DLCO)亦多受损。若为移植后BOS患者,可根据国际标准进行分级。新兴技术如强迫震荡法(FOT)、肺清除指数(LCI)可用于小气道病变的早期发现。
高分辨率CT(HRCT)是识别细支气管病变的重要工具。直接征象包括壁增厚、支气管扩张、树芽征、腔道填塞;间接征象包括空气滞留、马赛克样密度改变。各型细支气管炎具有一定影像学特征性,如DPB以树芽征为主,滤泡性细支气管炎以双肺下叶细小结节为主。
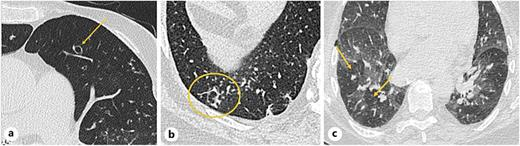
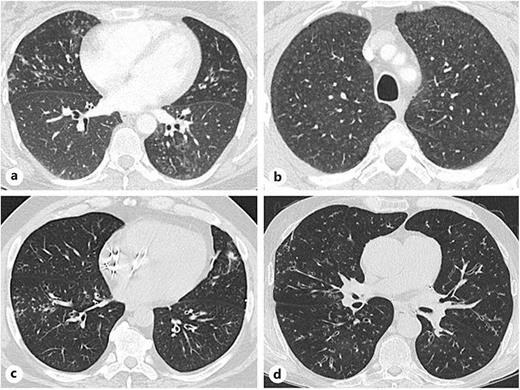
病理虽非必需,但在疑难病例中可提供决定性诊断依据。急性型以炎性细胞浸润、管腔渗出为主,呼吸型见棕褐色色素巨噬细胞聚集,限制型以纤维化为主,滤泡型见淋巴滤泡形成,DPB为泡沫样巨噬细胞为主的变性性炎症。
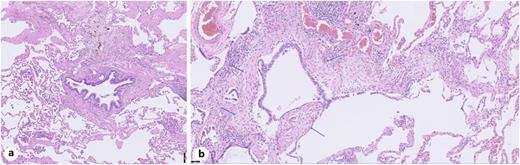
图 原发性细支气管炎的病理图像。a 呼吸性细支气管炎:在呼吸性细支气管内可见棕褐色色素化的巨噬细胞。细支气管壁因黏膜下炎症和纤维化而增厚。b 限制性细支气管炎:管壁的黏膜下和周围细支气管炎症,伴有上皮下胶原蛋白沉积。
支气管镜、BAL、血清自身抗体检测、HLA基因型分析等亦可根据临床怀疑酌情进行。
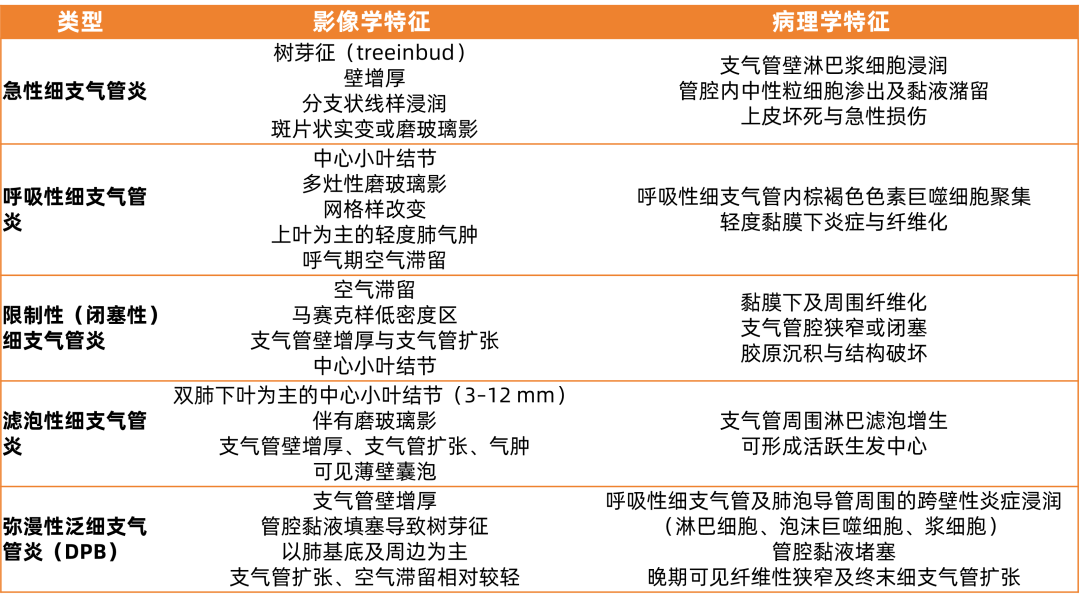
表1 原发性细支气管炎的影像学和病理表现总结
治疗需基于明确病因,主要原则包括去除诱因、对症支持及免疫/抗感染治疗等:
以支持治疗为主,轻症患者多可自限。合并细菌感染者应及时给予抗菌药物。对免疫功能低下者可考虑使用抗病毒药物(如利巴韦林),但证据尚不充分。
支气管扩张剂、吸入糖皮质激素在临床中常被使用,但并无明确证据可改善临床结局,更多为对症处理。对于反复发作患者,免疫重建及长期抗生素预防可予考虑。
治疗以支持为主,包括避免继发吸入物暴露、加强肺康复、疫苗接种(流感、肺炎球菌、COVID-19)及营养支持。部分文献报道早期使用系统性糖皮质激素(如冲击剂量甲泼尼龙)可缓解肺部空气滞留,改善CT表现,推测其机制在于抑制早期炎性反应与纤维化过程,但应权衡副作用及患者耐受性。
大环内酯类药物如阿奇霉素可通过抑制中性粒细胞与细胞因子产生发挥抗炎作用,已在部分儿童研究中证实可减少喘息发作与住院率,成人PIBO患者的证据仍有限。
关键在于去除诱因。对于急性暴露后出现肺损伤者,可给予系统性糖皮质激素以减少后续纤维化风险。慢性职业性暴露相关细支气管炎尚无确切治疗方案,吸入性糖皮质激素、大环内酯类或免疫调节剂疗效证据不足。
应全面评估患者误吸风险,包括神经肌肉疾病、胃食管反流、吞咽障碍、镇静药使用等。治疗应聚焦于诱因控制,如使用质子泵抑制剂、调整体位、必要时行抗反流手术。若合并感染,应予以积极抗感染治疗。
该类患者需个体化管理,治疗目标为控制炎症、减缓肺功能下降。可考虑:
* 调整免疫抑制剂(如环孢素改为他克莫司);
* 联合使用阿奇霉素(250 mg/日 ×5天,继以每周3次);
* 光免疫治疗、全淋巴照射、ATG等二线治疗;
* 必要时行抗反流手术;
* 终末期可考虑再次移植。
阿奇霉素在BOS患者中应用广泛,若BAL液中中性粒细胞比例升高,则响应更佳。
滤泡性细支气管炎治疗以原发病控制为主,尚无标准方案,吸入性糖皮质激素、支扩剂及大环内酯类可试用。
DPB则是大环内酯类治疗效果最明确的疾病之一,推荐至少连续服用红霉素200\~600 mg/d,疗程不少于6个月;吸入支扩剂可作为辅助治疗。激素疗效不佳。
细支气管炎的预后依其病因而异:
* 急性感染性细支气管炎多数预后良好,死亡率低于1%;
* 呼吸型患者如能戒烟则病变可逆;
* 限制型尤其是BOS进展性强,生存率较差;
* PIBO早期识别并治疗者预后优于移植后BOS;
* DPB应用大环内酯治疗后5年生存率提升至90%以上。
随访建议包括肺功能动态监测、HRCT影像比较及临床症状评估。对移植后患者可参照国际BOS分级标准,定期评估FEV₁及BAL细胞学。
细支气管炎作为一类异质性强、病因复杂的小气道疾病,在临床中常被低估与误诊。随着多参数肺功能技术、高分辨率影像及免疫学检查的发展,早期识别与分型成为可能。临床管理应基于病因识别、个体化评估与多学科合作,未来需更多高质量临床研究以建立分型明确、证据充分的治疗策略。

(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)