患者身体功能差,需拄拐杖行走,无跌倒或
生化检查显示低钙(8.5 mg/dL)、磷控制良好(3.4 mg/dL)、维生素D水平正常偏低(23 ng/mL,在CKD背景下偏低)、甲状旁腺素(PTH)正常(53 pg/mL;参考范围14-64,但对ESKD患者而言偏低),骨特异性碱性磷酸酶(BALP)正常(22.8 U;参考范围5.6-29.0)。C-末端肽(CTX)升高(1998 pg/mL;参考范围40-465)。
CKD-MBD的骨组成部分称为肾性骨
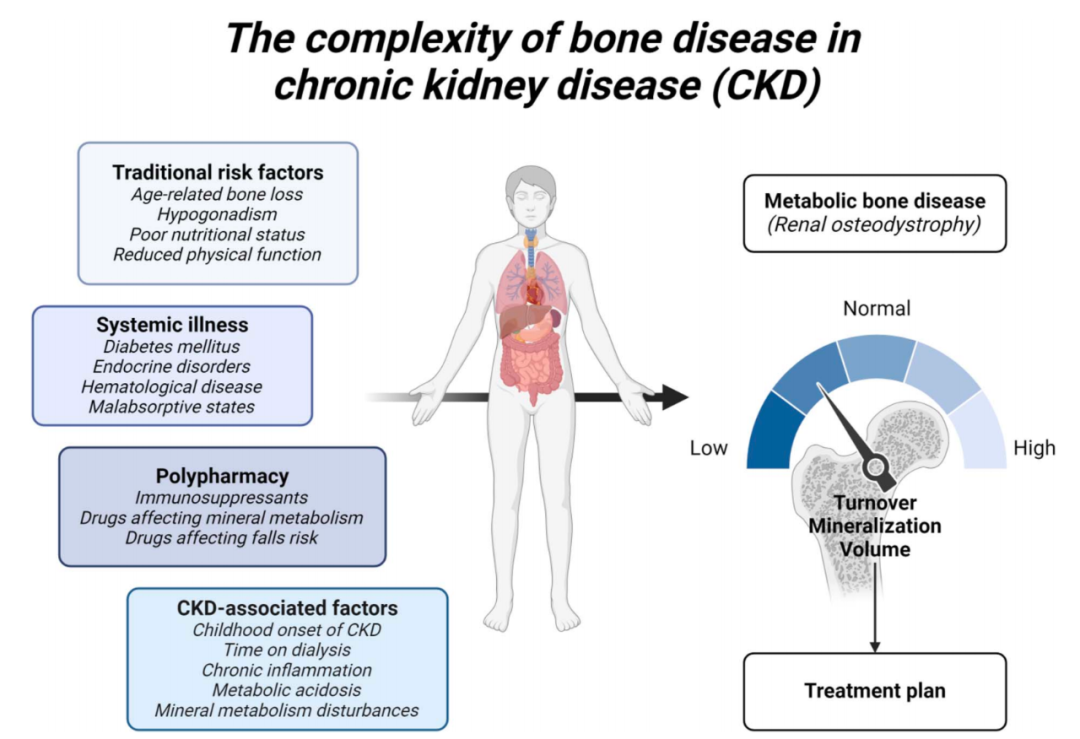
图1. 在CKD中,由传统和非传统危险因素组成的多因素背景导致骨脆性增加。CKD相关骨质疏松的治疗计划必须考虑持续的矿物质代谢紊乱以及代谢性骨病类型,由骨转换、矿化、微结构和体积定义。
由于患者既往接受了甲状旁腺切除术,且目前PTH水平对透析患者来说明显偏低(透析患者的PTH推荐范围是检测方法参考范围上限的2-9倍),临床上先验地怀疑患者存在低骨转换状态。
然而,骨转换标志物并不完全支持这一诊断,因为BALP在正常范围内。CTX在这种情况下价值有限,因为它在CKD中肾脏排泄受损,会在体内积累。由于患者存在
因此,进行了
表 1. 终末期慢性肾脏病合并骨质疏松症患者在骨合成代谢治疗前后的
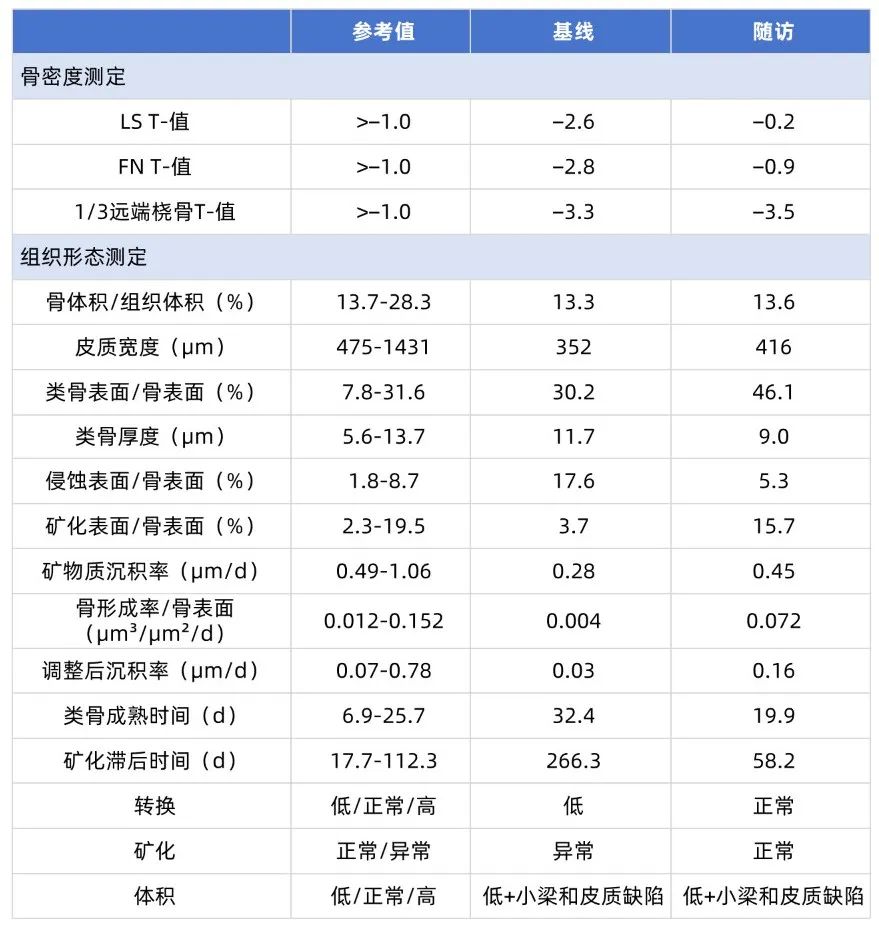
根据骨活检结果,最终诊断为甲状旁腺功能低下(由于PTH反应性降低),伴低骨转换、矿化缺陷(骨软化症)和骨质疏松症。骨质疏松可能与长期CKD、既往严重甲状旁腺功能亢进以及儿童期疾病、
治疗计划首先针对骨矿化缺陷进行钙和强化维生素D补充,然后进行骨促进治疗以改善骨量。透析液钙浓度从2.5增加到3.0 mEq/L,同时给予每日钙1000 mg和大剂量麦角钙化醇50000 IU/周,持续4周,随后改为每日胆钙化醇4000 IU。3个月和6个月的复查实验室检查表明MBD参数达标,之后开始为期2年的
治疗过程中,患者接受
为确定治疗对骨组织质量的影响,以及是否需要抗骨吸收剂巩固治疗,进行了复查骨活检。治疗后的骨活检显示骨转换正常,骨矿化改善。活性骨细胞较少,提示抗骨吸收剂治疗收益有限。患者继续停用任何骨靶向治疗,仅监测BALP水平。
治疗后6个月,BALP降至12.9 U。治疗终止12个月后的随访DXA显示脊椎(+7%)和远端桡骨(+3.4%)骨密度继续改善,髋部保持稳定(−0.7%)。治疗终止24个月后的随访DXA显示脊椎(−2.1%)、髋部(−0.8%)和远端桡骨(+0.1%)的骨密度继续稳定。患者随后成功接受了脊椎矫正手术。
CKD患者的治疗决策必须同时考虑矿物质代谢紊乱和骨质疏松。确定骨转换状态是选择合适治疗的关键。重要的是,目前没有针对CKD G4-5D患者的骨质疏松症批准疗法,也没有随机研究以骨折结局为终点。因此,治疗决策主要基于临床判断。
骨促进剂在治疗CKD相关骨质疏松中可能特别有价值,因为低骨转换是当代CKD队列中最常见的骨表型。然而,关于特立帕肽、阿巴拉肽和罗莫佐单抗在CKD中使用的数据仍然有限。本例中选择特立帕肽的基础是已发表的病例系列,报告了CKD患者低骨转换的骨骼重塑正常化。
未解决的问题包括:
透析患者的最佳PTH目标尚不清楚;当前建议基于与死亡率的关联,而非骨骼结局。
基于TMV分类的骨折风险尚未确立;这三项指标如何相互作用影响骨折风险尚不清楚。
高级CKD中骨促进剂或抗骨吸收剂的选择尚不明确,因为没有这些潜在治疗的随机试验。
非肾排泄骨生物标志物在CKD中建立诊断和监测治疗反应的临床实用性尚不明确。
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)