导读
痛风是一种与
2025年6月11-14日,备受瞩目的欧洲风湿病学年会(EULAR)在西班牙巴塞罗那隆重举行。会上展示了多项痛风治疗新进展,其中由复旦大学附属华山医院邹和建教授和薛愉教授团队发表的《Genakumab reduces the risk of acute gout flares during initiation of urate-lowering therapy: A phase 2, randomized, open-label, multi-center, active-controlled clinical trial》(OP0299)研究探讨了伏欣奇拜单抗在降尿酸治疗初期对痛风发作的预防疗效[4],薛愉教授在大会上对该研究进行了精彩的口头报告。基于此,本期特邀薛愉教授对该研究进行详细解读,以期为痛风的临床管理提供指导。
专家简介
邹和建 教授
复旦大学附属华山医院
复旦大学附属华山医院风湿免疫科学术带头人、教授
复旦大学风湿免疫过敏性疾病研究中心主任
国际
中华预防医学会风湿病预防专委会主任委员
中华医学会风湿病学分会第7、8届委员会副主任委员
中国医师协会风湿免疫科医师分会第1、2届委员会副会长
薛愉 教授
复旦大学附属华山医院
风湿免疫科副主任、主任医师、硕士生导师
上海市医学会风湿病专科分会副主任委员
中华医学会风湿病专科分会委员

研究背景
痛风是一种与高尿酸血症密切相关的炎症性关节炎。痛风患者开始降尿酸治疗(ULT)后,由于血尿酸水平的波动易诱发
研究目的
本项研究旨在探索伏欣奇拜单抗与
研究方法
这是一项随机、开放标签、阳性药物对照的2期临床试验(NCT05936281),在中国41个中心进行,包括1周的筛选期和12周的治疗期。纳入患者年龄在18-75岁之间。所有纳入患者在治疗期第1天按1:1:1的比例随机接受伏欣奇拜单抗100 mg或200 mg单次皮下注射,或口服秋水仙碱0.5 mg/天,持续12周。ULT在基线或筛选前1周开始,并在所有随机分配的患者中持续治疗12周。ULT方案包括口服
主要疗效终点在全分析集(FAS;所有接受≥1剂研究药物且有≥1次给药后疗效评估的随机患者)和符合方案集(PPS;FAS中无影响疗效的重大方案偏离的患者)中评估;次要疗效终点仅在FAS中评估。
主要疗效终点是12周内每位患者的急性痛风发作次数。次要疗效终点包括12周内经历≥1次急性痛风发作的患者比例、随机至首次急性发作时间以及痛风发作平均持续时间。安全性评估包括不良事件(AE)的发生率、实验室检查、生命体征和体格检查。免疫原性通过抗药物抗体(ADAs)和中和抗体(NAbs)的发生率来评估。
研究结果
1. 患者基线特征
研究纳入2023年7月20日至2024年1月19日期间的165名患者,其中162名患者接受了伏欣奇拜单抗100 mg(n=55)、200 mg(n=52)或秋水仙碱(n=55)治疗。所有纳入患者均为男性,平均(标准差[SD])年龄为40.8(11.7)岁,体重为81.0(13.7)kg,BMI为27.2(3.8)kg/m²。痛风病史平均时长为66.7(49.2)个月。总体而言,各治疗组在基线时的人口统计学和疾病特征基本相似。
2. 与秋水仙碱组相比,伏欣奇拜单抗组急性痛风发作更少
在12周治疗期间,伏欣奇拜单抗200 mg组中没有患者出现急性痛风发作,伏欣奇拜单抗100 mg组中仅1名患者(1.8%)出现了一次持续2.0天的急性痛风发作,人均发作0.02次。相比之下,秋水仙碱组中有12名患者(21.8%)出现了≥1次痛风发作,8名(14.5%)、3名(5.5%)和1名(1.8%)患者分别经历了1次、2次和5次发作,人均发作0.34次,平均持续时间为11.6天。负二项回归模型显示,与秋水仙碱相比,伏欣奇拜单抗100 mg显著降低了12周内人均发作次数(率比=0.05;95% CI:0.01, 0.43;p=0.0060);伏欣奇拜单抗200 mg组中未发生急性痛风发作,模型无法估计相较秋水仙碱的人均发作次数比值。
接受伏欣奇拜单抗治疗的患者12周内≥1次急性痛风发作的比例明显低于秋水仙碱组:伏欣奇拜单抗100mg组和秋水仙碱组的组间差异为-20.0%(95% CI:-31.47%,-8.53%);伏欣奇拜单抗200mg组和秋水仙碱组的组间差异为-21.8%(95% CI:-32.73%,-10.9%)。
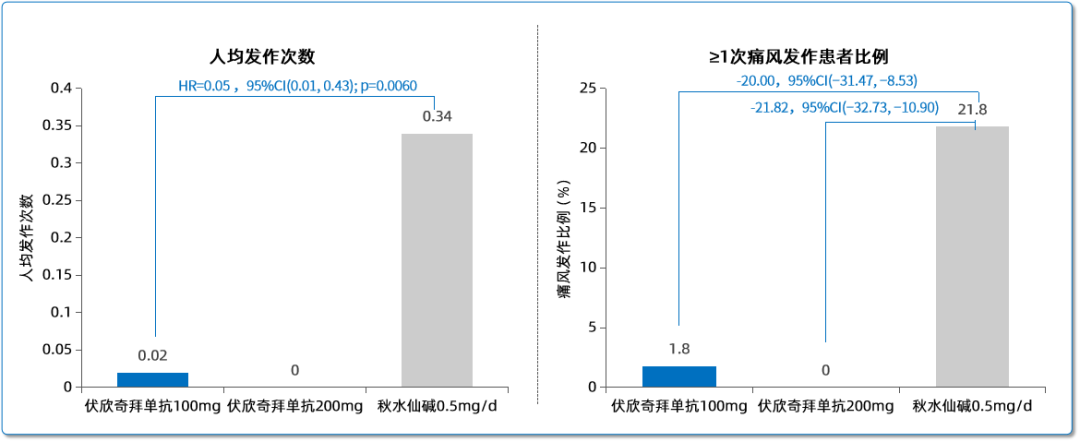
图1 各治疗组中痛风发作的次数和比例
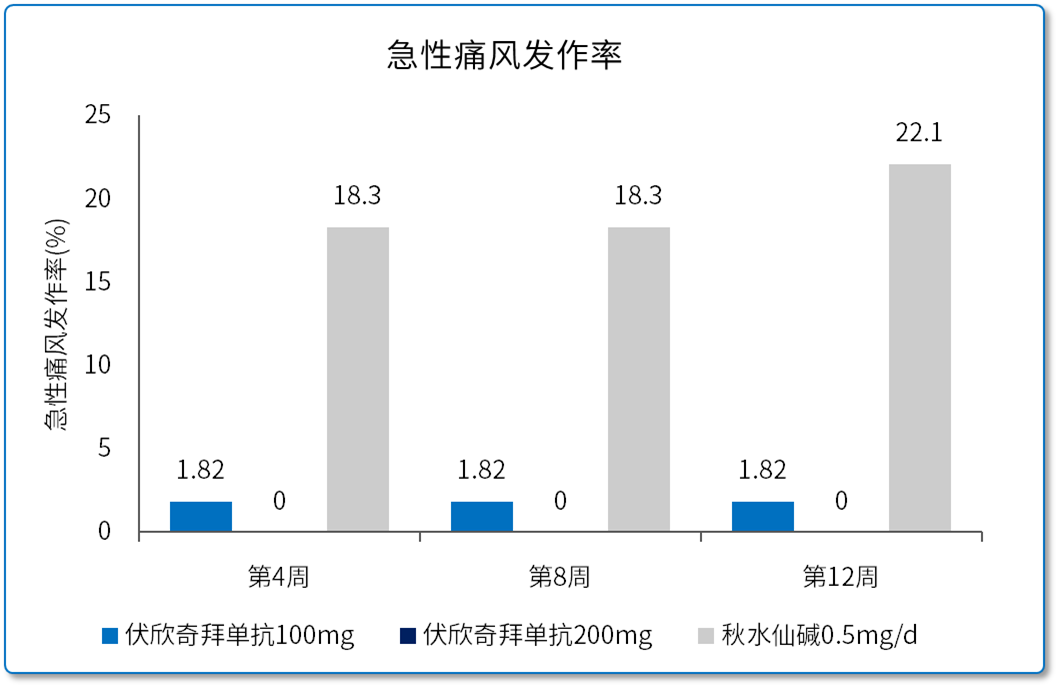
图2 各治疗组在不同治疗时间的急性痛风发作率
3. 伏欣奇拜单抗治疗期间表现出良好的安全性
伏欣奇拜单抗100 mg组、200 mg组和秋水仙碱组中,治疗期间出现的不良事件(TEAEs)的患者比例分别为80.0%(n=44)、76.9%(n=40)和76.4%(n=42)(表1),其中高甘油三酯血症和
表1 各治疗组不良事件汇总(SS)

数据以病例数(%)表示,以每组的患者数为分母。如果同一患者出现多次相同的治疗期间不良事件(TEAE),则仅计算一次;如果同一患者出现多次相同但严重程度或因果关系不同的TEAE,则根据最大数量计算病例数;严重或最相关的类别仅计算一次。严重程度使用不良事件通用术语标准(CTCAE V5.0)进行评估。
AE:不良事件;SAE:严重不良事件;SS:安全性分析集;TEAE:治疗期间出现的不良事件;TRAE:治疗相关不良事件
4. 伏欣奇拜单抗的免疫原性较低,治疗期间未观察到与ADAs相关的安全性事件
在各治疗组中观察到抗药物抗体(ADAs)阳性率较低,且未报告与ADAs阳性相关的安全性事件,也未检测到中和抗体(NAbs)。
研究结论
伏欣奇拜单抗用于ULT初始阶段的预防治疗,可显著降低痛风患者急性痛风发作,并且显示出良好的耐受性。伏欣奇拜单抗(100或200 mg)降低了患者在12周内的人均发作次数,并缩短了发作持续时间,其安全性与秋水仙碱相似。值得注意的是,在伏欣奇拜单抗200 mg组中,治疗12周内未观察到痛风发作,这一发现值得在更大的样本人群中进一步研究。
千淘万漉虽辛苦,吹尽狂沙始到金!在痛风治疗的探索之路上,科研人员历经重重挑战与艰辛,不懈探寻更为有效的治疗方案。伏欣奇拜单抗的问世,恰似狂沙吹尽后闪耀的金光,为痛风患者带来了新的希望与曙光。伏欣奇拜单抗作为我国首款治疗急性痛风性关节炎的1类创新药,精准直击IL-1β,阻断炎症级联反应,疗效显著,开启了中国原研新药精准靶向治疗痛风的新篇章。未来,伏欣奇拜单抗有望为痛风患者提供从治疗到预防的全病程管理,助力更多患者解脱病痛的枷锁,重拾健康与自由的生活。
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)