医脉通编辑整理,未经授权请勿转载。
复发/难治性(R/R)

II/III期WaveLINE-003试验纳入了接受≥1线治疗后确诊为R/R DLBCL的成人患者(队列A),这些患者不适合CAR-T细胞疗法、
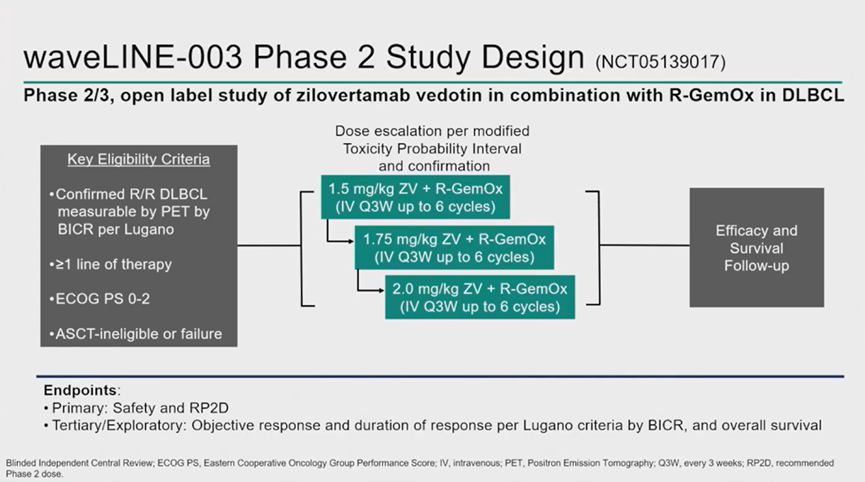
主要终点为安全性和推荐的II期剂量(RP2D)。次要终点包括根据Lugano 2014缓解标准经中心评估的客观缓解率(ORR)和缓解持续时间(DOR),以及总生存期(OS)。
截至数据截止日期(2024年8月1日),队列A共纳入40例患者,接受R-GemOx联合ZV 1.5 mg/kg(n=17)、1.75 mg/kg(n=16)或2.0 mg/kg(n=7)治疗;其中22例(55%)≥65岁,8例(20%)在>12个月后复发。既往治疗线数的中位数为2,7例(18%)患者曾接受CAR-T细胞治疗,7例(18%)曾接受ASCT。
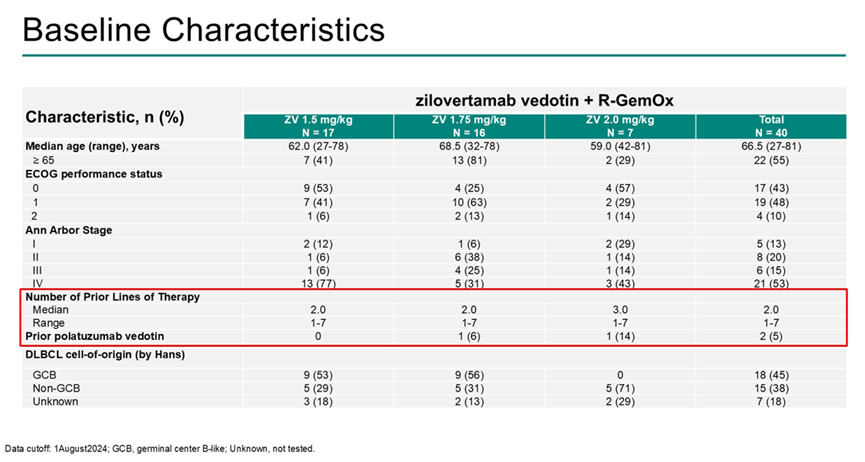
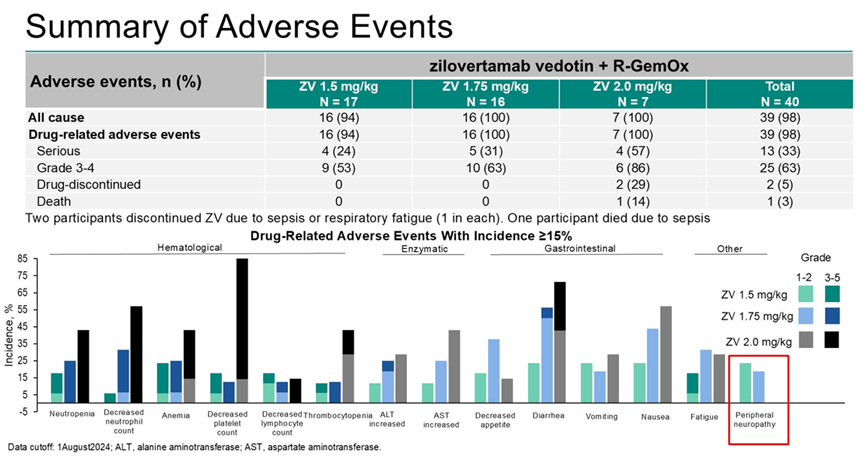
中位随访时间为9.8个月。报告了7例剂量限制性毒性(DLT)(ZV 1.5 mg/kg组1例,1.75 mg/kg组2例,2.0 mg/kg组4例)。39例(98%)患者出现治疗相关不良事件(AE),最常见的为
ORR分别为26.7%(3例完全缓解[CR],1例部分缓解[PR] [ZV 1.5 mg/kg])、56.3%(8例CR,1例PR [ZV 1.75 mg/kg])和57.1%(3例CR,1例PR [ZV 2.0 mg/kg]),中位DOR分别为14.4个月、8.7个月和未达到(NR)。中位总生存期为11.5个月(ZV 1.5 mg/kg)、NR(ZV 1.75 mg/kg)和7.4个月(ZV 2.0 mg/kg),6个月OS率分别为70.0%、78.8%和68.6%。
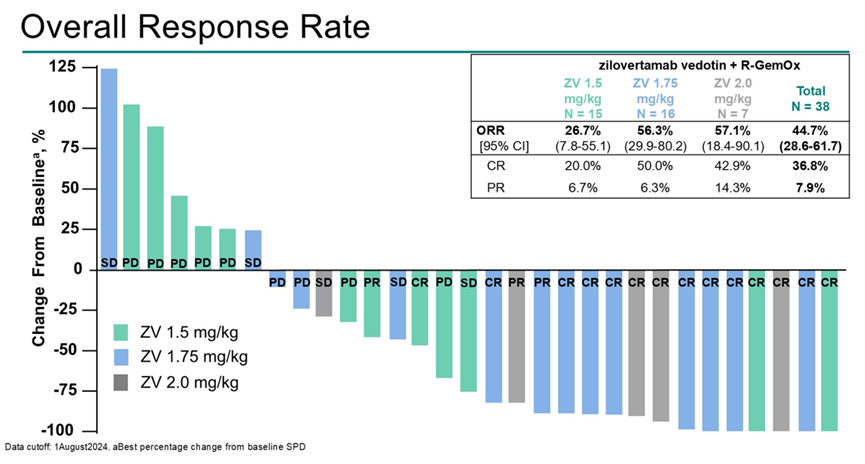
在RP2D为ZV 1.75 mg/kg联合R-GemOx时,Zilovertamab vedotin联合R-GemOx在R/R DLBCL中显示出有希望的疗效和可接受的安全性。该研究正在进入III期部分,将患者随机分配至ZV-RGemOx组与RGemOx组。
马军教授:尽管DLBCL一线治疗方案已取得显著进步,但仍有30%-40%患者会发展为复发/难治性,此类患者若不适合CAR-T细胞治疗或ASCT,传统挽救化疗缓解率不足30%,临床存在显著未满足需求。新型靶向ROR1 ADC药物Zilovertamab vedotin联合R-GemOx方案在临床试验中展现出56.3%的客观缓解率(ORR),1.75 mg/kg剂量下安全性可控,尤其在老年患者及多线治疗失败人群中显示出明确疗效,为R/R DLBCL提供了新的治疗选择。
我国DLBCL患者基数庞大,约40%~50%患者因年龄、合并症或经济因素无法获得CAR-T等先进治疗,亟需低毒高效且可及性强的创新方案。期待III期临床试验进一步验证其长期生存获益。同时,我国需加速国产ADC药物的研发进程并推动创新药物纳入医保体系,以缩小区域治疗差距,为R/R DLBCL患者提供更优化的治疗选择。

马军 教授
主任医师,教授,博士生导师
哈尔滨血液病肿瘤研究所所长
中国临床肿瘤学会(CSCO)监事会监事长
亚洲临床肿瘤学会副主席
中国临床肿瘤学会
国家卫生健康委能力建设与继续教育中心肿瘤学科专家组组长
白血病·淋巴瘤杂志 总编辑
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)