编辑:Yuna
医脉通整理,未经授权请勿转载
欧洲肿瘤内科学会亚洲年会(ESMO ASIA)由欧洲肿瘤内科学会主办,是亚太地区讨论肿瘤学领域最新数据和突破的领先平台。会议汇聚最具经验的国际专家,对最新学术研究和临床进展进行展示和探讨,并为肿瘤领域专家和学者提供重要的交流机会。2022年ESMO ASIA于12月2至4日在新加坡+线上召开。会议首日,国内肺癌领域大咖程颖教授、陆舜教授、方文峰教授在胸部肿瘤专场公布了最新研究进展,详情如下:
ASTRUM-005研究最新结果公布
PD-L1抑制剂联合化疗是小细胞肺癌(SCLC)领域的里程碑式进展,PD-L1抑制剂已获批用于广泛期小细胞肺癌(ES-SCLC)的一线治疗。今年ASCO年会上,吉林省肿瘤医院程颖教授公布了

程颖教授口头报告
方法
ASTRUM-005是一项随机、双盲、国际、多中心、III期研究(NCT04063163)中,初治ES-SCLC患者按 2:1 比例随机分配接受斯鲁利单抗(4.5 mg/kg)或安慰剂联合

研究设计
结果
2019年9月12日至2021年4月27日期间,585例患者被随机分组,斯鲁利单抗组和安慰剂组分别有389例和196例。2022年6月13日数据截止时,中位随访时间为 19.8个月。与安慰剂组(11.1个月)相比,斯鲁利单抗组(15.8个月)的中位OS显著改善(HR=0.62,95% CI 0.50–0.76;P <0.001)。

OS更新结果

OS亚组分析结果
根据 RECIST v1.1由独立放射学审查委员会(IRRC)评估的中位 PFS 也明显改善,斯鲁利单抗和安慰剂组的中位PFS分别为5.8个月和4.3个月(HR=0.47,95% CI 0.38–0.58)。

PFS分析结果
亚组分析显示,亚裔和非亚裔OS(HR 0.63 vs 0.56)和PFS(HR 0.47 vs 0.53)改善趋势类似。

亚洲 vs 非亚洲OS分析

亚洲 vs 非亚洲PFS分析
由IRRC评估的ORR分别为68.9%和58.7%疗效分析

安全性分析
结论
斯鲁利单抗+化疗在初治ES-SCLC患者中显示出较好的抗肿瘤活性和良好的安全性。亚组分析显示出一致的OS获益。ASTRUM-005研究结果支持首个用于SCLC的PD-1抑制剂斯鲁利单抗联合化疗用于初治ES-SCLC的一线治疗。
新型第三代EGFR TKI befotertinib 颅内疗效优
Befotertinib(D-0316)是一种新型高选择性口服第三代 EGFR-TKI,在 EGFR T790M 突变阳性患者的关键 II 期研究(NCT03861156)中显示出令人鼓舞的抗肿瘤活性。今年ESMO AISA大会上,上海交通大学附属胸科医院陆舜教授公布了一项III 期、开放标签、随机对照研究结果,该研究旨在评估befotertinib对比

陆舜教授口头报告
方法
EGFR敏感突变、符合条件的 IIIB/IIIC/IV 期 NSCLC 患者被随机分配(1:1)接受befotertinib(75-100mg,每天一次)或埃克替尼(125mg,每天三次)作为一线治疗。主要终点是由独立审查委员会(IRC)评估的PFS。次要终点包括ORR、DCR、DOR、OS和安全性。数据截至日期为2022年7月31日。
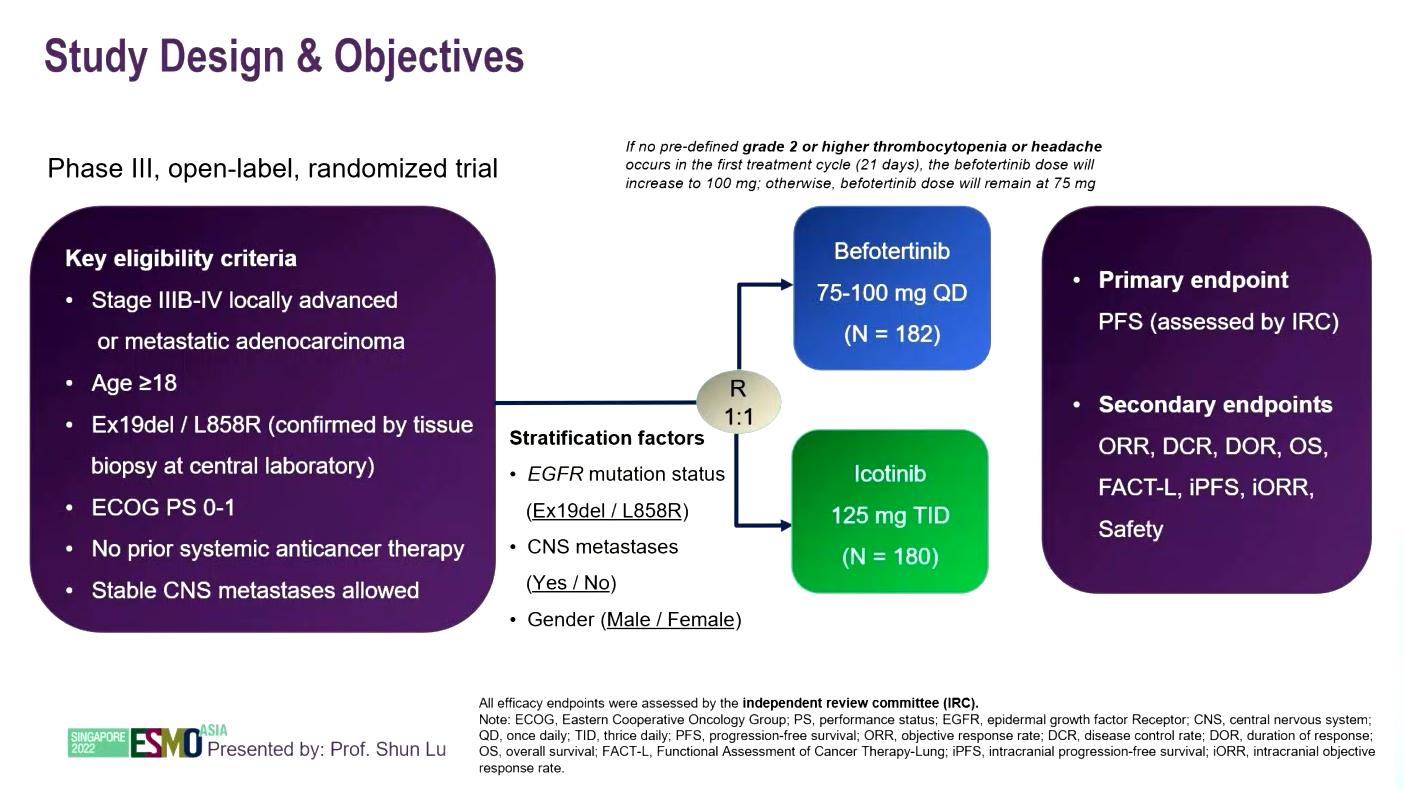
研究设计
结果
2019年12月24日至 2020年12月28日期间,362例患者被随机分配接受Befotertinib(n=182)和埃克替尼(n=180)治疗。在中位随访 20.6个月时,由IRC评估的befotertinib组和埃克替尼组的中位PFS分别为22.1个月和13.8个月(HR= 0.49 [95% CI 0.36-0.68];P<0.0001)。

PFS结果
在有和无中枢神经系统(CNS)转移患者和不同EGFR敏感突变亚型中befotertinib均显示获益。

根据脑转移分层的PFS结果

不同EGFR敏感突变的PFS结果
Befotertinib组和埃克替尼组的 ORR 分别为75.8%和78.3%,两组的DCR分别为94.5%和98.3%,两组的中位DOR分别为未达到和12.4个月,两组的 OS 数据都不成熟,两组的中位治疗持续时间分别为16.4个月和11.1个月,两组的颅内ORR分别为92.3%和55.6%,颅内PFS分别24.9个月和15.2个月。

疗效分析
Befotertinib组和埃克替尼组分别有86例患者(47.3%)和54例患者(30.0%)发生3级及以上治疗相关不良事件(TEAE),两组中分别有2 例(1.1%)和1例(0.6%)患者发生与药物相关的死亡事件。
安全性分析
结论
与埃克替尼相比,befotertinib在EGFR敏感突变阳性 NSCLC 晚期患者一线治疗中显示出更优的疗效,且安全性可接受。
III期FL-ALTER:
安罗替尼是一种口服多靶点酪氨酸激酶抑制剂,可有效抑制VEGFRs、FGFRs、PDGFRs、c-kit和MET2。今年ESMO AISA大会上,中山大学肿瘤防治中心方文峰教授公布了III期FL-ALTER研究结果,该研究旨在评估安罗替尼或安慰剂联合吉非替尼在初治EGFR 突变转移性 NSCLC 患者中的疗效和安全性。

方文峰教授口头报告
方法
符合条件患者为年龄 18~75岁、EGFR 19外显子缺失或 21外显子L858R点突变的IIIB 或 IV 期 NSCLC患者,ECOG PS为 0 或 1,根据 RECIST v1.1评估有可测量的病灶和足够的器官功能。入组患者按1:1比例随机分配,分别接受口服吉非替尼(250 mg QD)+安罗替尼(G+A 组,12 mg QD,第 1-14 天,每个周期 21 天)或吉非替尼+安慰剂(G+P 组)治疗,直至疾病进展或出现不可接受的毒性。主要终点是由 IRC评估的PFS。次要终点包括OS、ORR、疾病控制率(DCR)、DOR和安全性。基线时、首次评估时和疾病进展(PD)时收集用于 ctDNA 分析的血液样本,并使用 329个基因的panel进行分析。

研究设计
结果
2019年4月到 2021年 8月期间,共315例患者被分配至 G+A(n=157)或 G+P 组(n=158)。2022 年 7 月 31 日数据截止时,G+A组和G+P组的中位随访时间为17.3个月和18.8个月。与G+P组相比,G+A 组患者由IRC评估的中位PFS 明显更优(14.75个月 vs 11.20个月;HR= 0.64,P = 0.0028)。

PFS结果
G+A组和G+P组确认的 ORR分别为76.13%和64.52%。与 G+P相比,G+A组患者的缓解持续时间更长(中位DOR:12.48个月 vs 9.46个月,HR=0.56,P=0.0003)。

次要终点结果
OS数据仍不成熟。G+A组和G+P组3级及以上TEAE发生率分别为49.68%和30.97%。最常见的3级及以上 TEAE为高血压(29.68%,G+A组) 和ALT 升高(12.26%,G+P组)。

安全性分析
可评估ctDNA数据的289例患者的初步分析表明,EGFR拷贝数变异患者更能从G+A组中获益(对比G+P组)(11.74个月 vs 6.83个月;HR=0.27)。

生物标志物分析
结论
FL-ALTER是安罗替尼联合吉非替尼用于EGFR突变晚期NSCLC的首个III期研究。与G+P组相比,G+A组可显著延长初治转移性EGFR突变NSCLC患者的PFS,且安全性可控。安罗替尼联合吉非替尼有望成为用于EGFR突变NSCLC患者新的一线治疗选择。
参考文献:
LBA9 - Updated results of first-line serplulimab versus placebo combined with chemotherapy in extensive-stage small cell lung cancer: An international multicentre phase III study (ASTRUM-005).2022 ESMO ASIA. Proffered Paper session: Thoracic cancers.
LBA6 - Befotertinib (D-0316) versus icotinib as first-line therapy for patients with EGFR-mutated locally advanced or metastatic non-small cell lung cancer: A multicentre, open-label, randomized phase III study.2022 ESMO ASIA.Proffered Paper session: Thoracic cancers.
LBA10 - A multicenter, randomized, double-blind, phase III study of gefitinib in combination with anlotinib or placebo in previously untreated patients with EGFR mutation-positive advanced non-small cell lung cancer (FL-ALTER).2022 ESMO ASIA. Proffered Paper session: Thoracic cancers.
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)